重症COVID-19患者的急性肾损伤(上)


翻译:刁孟元
摘要
急性肾损伤(AKI)在SARS-CoV-2感染的危重病人中的发生率高达25%,特别是在那些有潜在合并症的病人中。在这种情况下,AKI与高死亡率相关,特别是当需要肾替代治疗时。一些研究强调了尿沉渣的变化,包括蛋白尿和血尿,以及尿中SARS-CoV-2排泄的证据,表明存在该病毒的肾贮库。COVID-19相关AKI的病理生理可能与非特异性机制有关,但也可能存在与AKI的发病机制有关COVID-特殊机制,如病毒通过受体(ACE2)进入导致的直接细胞损伤,这个受体在肾脏高表达,是一种不平衡的肾素-血管紧张素-醛固酮系统,病毒感染和血栓事件可引发的促炎性细胞因子释放。非特异性机制包括血流动力学改变、右心衰、需要机械通气的患者高水平PEEP、低血容量、肾毒性药物的使用和脓毒症。到目前为止,还没有针对COVID-19诱导的AKI的专门治疗方法。目前正在研究一些用于COVID-19抗病毒/免疫调节治疗的研究药物,它们对AKI的影响尚不清楚。肾替代治疗的适应症、时间和方式目前依赖于非特异性数据,主要集中在脓毒症患者。为了预测发生AKI的风险,确定肾损伤的确切机制,并提出针对性的干预措施,迫切需要对COVID-19患者的AKI进行进一步研究。
关键词:急性肾损伤,COVID-19,重症监护病房,肾素-血管紧张素-醛固酮系统
前言
自2019年12月以来,一种名为SARS-CoV-2的新型冠状病毒引发了一场名为COVID-19的国际呼吸道疾病暴发。2020年5月26日,世界卫生组织共报告新冠肺炎确诊病例5404,512例,死亡病例343,514例。急性肾损伤(AKI)是危重病人的常见情况,特别是那些有严重感染的病人,并与高发病率和死亡率有关。自新的SARS-CoV-2爆发以来,多项研究聚焦于肺部并发症,即急性呼吸综合征,这是重症监护病房(ICU)入院的主要症状,并与高死亡率相关。最初很少关注这些患者的AKI发生率,肾受累被认为是可以忽略的。然而,越来越多的证据表明,AKI在COVID-19患者中普遍存在,而SARS-CoV-2特别容易侵犯肾脏。
流行病学
Wang等对来自武汉的116例中国非危重症患者进行病例流行病学研究发现,在住院48小时内,仅有12例(10.8%)血清肌酐或尿素氮出现小幅升高。然而,这一观点受到了最近研究的挑战。如表S1所示,住院期间发生AKI的总体平均发病率为11%(8-17%),在危重病人中发病率最高(23%(14-35%))(表S1,图1,2)。
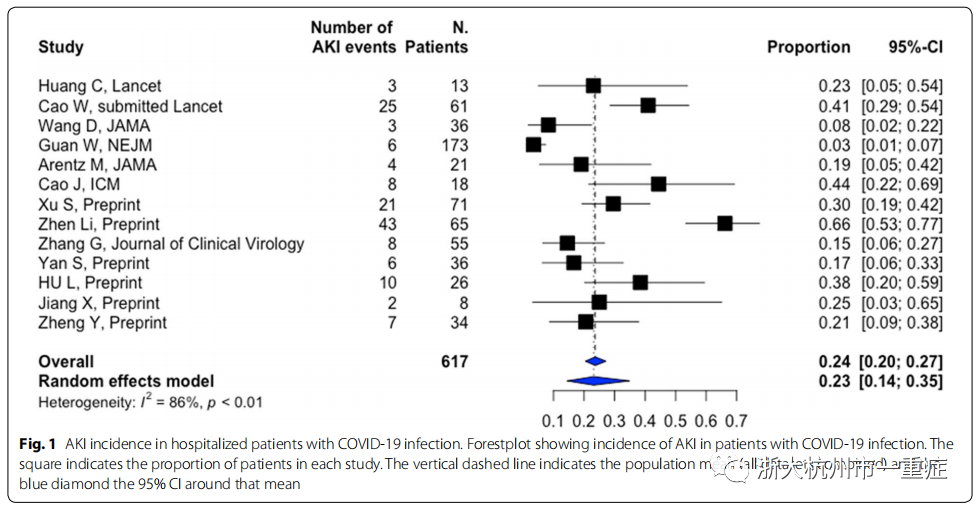
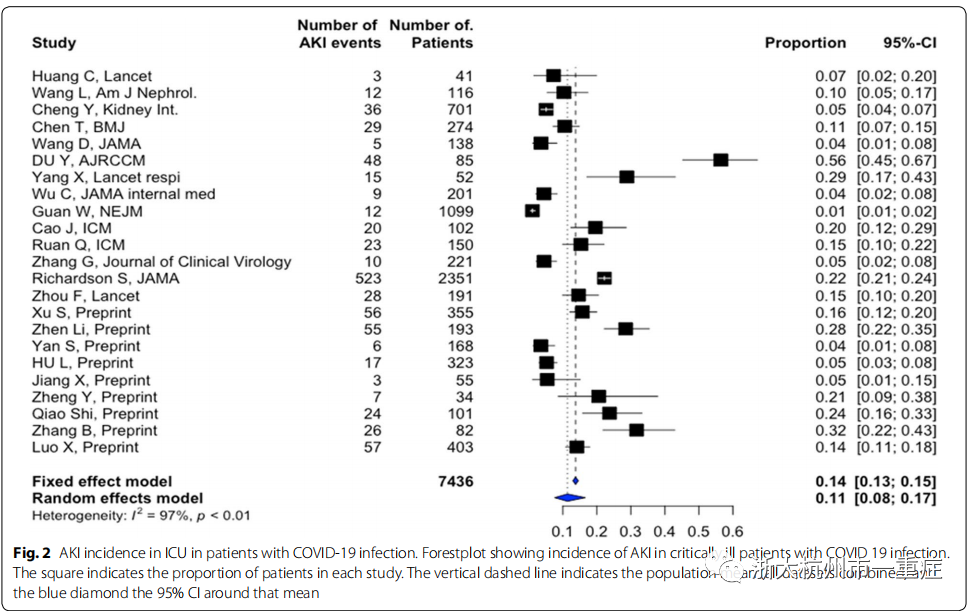
值得注意的是,近5%的危重病人使用了肾替代疗法(RRT)。必须谨慎解释这些结果。事实上,由于研究的回顾性设计以及大多数报告中缺乏明确的手术治疗AKI的情况,实际的AKI发生率,特别是在ICU中,仍不确定,可能被低估(表S1)。值得注意的是,虽然有几项研究已经使用了KDIGO,但没有一项研究报告AKI分期。在我们中心,在99例严重SARS-CoV-2感染的危重患者中,42例(42.9%)发生AKI,其中32例(74.4%)发生严重AKI(KDIGO3期),13例(13.4%)需要RRT(未发表数据)。研究中的这些差异可以用其他因素解释,如种族、患者特征(合并症、吸烟)、疾病严重程度(包括所有临床病例与仅包括实验室确诊病例),以及在局部实践中关于容量和血流动力学管理,通气策略和药物使用的变化。这些流行病学的信息也应该与以前在其他大流行过程中的报告相结合,例如H1N1流感,在那里已经描述了类似的事件。
AKI发病时间是另一个问题。只有4项研究报告了AKI在入院时的发病率,从1%到29%(表S1)。在大多数研究中,AKI在住院期间发展,平均在入院后5-9天出现。AKI在最严重的疾病(特别是需要有创机械通气的严重急性呼吸窘迫综合征)、老年人或有高血压、糖尿病等合并症的患者中更为常见。如表S1所示,这些情况经常出现在重症SARS-CoV-2感染住院患者中。
AKI是公认的不良预后因素。在SARS-CoV-2感染中,5项研究发现肾衰竭和死亡之间有显著的联系。有趣的是,Cheng等人发现,只有AKI 2期或更高期才与更高的死亡风险相关[HR: 3.53(1.5 8.27)]。
SARS-CoV-2感染期间的尿液分析
与血清肌酐升高导致的肾功能不全平行的是,一些研究强调了尿沉渣的异常。
蛋白尿和血尿
蛋白尿通常在SARS-CoV-2感染期间观察到,比例大概为7至63%的病例。Cheng等报道了26.7%的患者出现血尿。蛋白尿的两种表型已经被鉴定:大多数时候蛋白尿是低丰度的,在尿量尺上为1+,可能是由于肾小管损伤。在某些情况下,蛋白尿丰富或含有白蛋白,提示肾小球功能受损。病毒对足细胞的损伤以及RAAS的激活都可能导致蛋白尿:肾素内吞作用可能与血管紧张素II的积累有关,随后肾小球通透性增加而导致蛋白尿。2例因SARS-CoV-2感染住院的黑人患者报告了伴有重度AKI和组织学塌陷性肾小球病变的大量蛋白尿。这种形式的肾小球病变与多种情况有关,包括病毒感染。有趣的是,蛋白尿和血尿都与院内死亡率的增加密切相关。
对这些结果的解释应谨慎,原因有以下几点。首先,蛋白尿是在入院时测量的,之前没有可用的值。然而,这些研究中的患者往往表现出肾脏损害的危险因素,如糖尿病、高血压和超重。其次,与死亡率的相关性可能反映了SARS-CoV-2感染的严重程度,但也可能表明潜在的晚期患者病情。第三,特别是在黑人患者中,不能排除的是,APOL1基因变异可能参与了肾小球衰竭的发病机制。最后,对于危重症、发热和少尿的患者,应谨慎解释蛋白尿和血尿,特别是用试纸测定时。
尿钾排泄增加
在175例感染COVID-19的患者队列中,作为肾素-血管紧张素-醛固酮系统(RAAS)激活的标志,伴有尿增多的低钾血症与需要ICU治疗的最严重的SARS-CoV-2感染相关。事实上,在ICU住院的病人中,93%在入院时都有低钾血症。作者认为,尿钾增多与血管紧张素II水平升高有关。然而,需要对RAAS的所有组分进行特殊测量的数据来验证这一假设。事实上,低钾血症可能继发于SARS-CoV- 2引起的腹泻、使用利尿剂或其他药物引起的小管病变。
尿液中存在SARS冠状病毒2
在COVID-19患者的尿拭子中很少发现SARS-CoV-2,这增加了出现SARS-CoV-2肾库的可能性。然而,尿液拭子中病毒RNA的存在是否意味着尿液具有传染性,应通过活病毒检测来确定。Diao等人首先报道了6例死于COVID- 19的患者的肾组织的尸检分析。最近,Su等人分析了26例死于COVID-19的患者的肾脏组织病理学病变。利用光学显微镜、免疫组织化学和电子显微镜,他们报告了几种异常情况,包括:
1. 组织病理学结果与有严重SARS-CoV-2感染风险的患者(糖尿病、高血压、心血管疾病)的潜在条件有关,如糖尿病患者的结节性系膜扩张和小动脉透明变性,高血压和/或心血管疾病患者的小动脉硬化伴缺血性肾小球。
2. 直接肾实质感染的证据:Su等在光镜下发现了弥漫性急性近端肾小管损伤并伴有胞浆空泡,这可能与近端肾小管上皮的直接病毒感染有关。透射电镜观察,病毒颗粒主要分布在肾近端小管上皮的细胞质和足细胞中,并有次生足突出现和足细胞从肾小球基底膜脱离。3例肾小管上皮细胞间接荧光表达SARS-CoV核蛋白。Kissling等人报道了一例严重塌陷的局灶性肾小球病变,在足细胞的细胞质中有大量球形颗粒的空泡,具有典型的病毒包涵体外观。Puelles等人在COVID-19患者的肾脏解剖中也检测到SARS-CoV-2病毒载量呈阳性,且优先定位于肾小球。有趣的是,多种潜在疾病与SARS-CoV-2向肾性相关。这些研究提示SARS-CoV-2直接侵犯肾实质。
3.另一常见的形态是肾小球和管周毛细血管的弥漫性红细胞聚集和梗阻,无血小板、红细胞碎块、血栓或纤维蛋白样坏死。
4. 肾小球缺血和内皮细胞损伤也出现在一些病例中。Su等在3例肾小球毛细血管袢内有纤维蛋白血栓的患者中发现了肾小球缺血的证据,可能与COVID-19患者的凝血活化有关。
5. 其他组织学特征包括肌红蛋白铸型或细胞碎片铸型。在COVID-19患者中也有横纹肌溶解的报道。
6. 虽然SARS-CoV-2感染期间的肺损伤似乎部分与补体激活有关,但没有证据表明补体在肾脏中激活。
重要的是要记住,大多数的组织学数据来自于尸检分析。因此,很难断定这些组织学病变是病毒或脓毒症和/或多器官衰竭的直接后果。更多COVID-19存活患者的肾活检可能有助于回答这个问题。

相关阅读
- 09-13 第八期“浙大市一.临床大讲堂”预告
- 05-24 2021年第三届湖畔眼底病高峰论坛暨浙江省级继续医学教育项目《玻璃体视网膜疾病诊疗进展》圆满举办
- 10-29 COVID-19流行期间重症监护中的床旁肺部超声
- 10-29 肝硬化患者的自发性细菌性腹膜炎和腹膜外感染(上)
- 10-20 妊高症回顾(上)
- 10-20 妊娠期高血压疾病与心血管疾病相关发病率和死亡率的系统评价分析
- 10-07 急性心梗后超声可发现的机械性并发症
- 10-07 做了一回赵半仙--高血压心脏病
- 10-07 综合生命支持降低暴发性心肌炎死亡率的多中心研究(上)
- 10-07 经鼻雾化吸入(上)
