临床试验知多少(第二期)

上期百事通给小白讲解了什么是临床试验,临床试验的起源,相信大家也有了初步的了解。这一期,我们来聊聊临床试验的具体分期。
新药研发是一项长周期、高投入、高风险的工程,药物研发流程基本分为药物发现、临床前研究、临床研究以及上市后的安全性监督四个阶段。

其中临床研究阶段就是以药品上市注册为目的,为确定药物安全性与有效性在人体开展的药物研究,也就是临床试验。
中华人民共和国《药品注册管理办法》第二十一条,药物临床试验分为Ⅰ期临床试验、Ⅱ期临床试验、Ⅲ期临床试验、Ⅳ期临床试验以及生物等效性试验。根据药物特点和研究目的,研究内容包括临床药理学研究、探索性临床试验、确证性临床试验和上市后研究。两个分类系统都有一定的局限性,但两个分类系统互补形成一个动态的有实用价值的临床试验网络,如下图所示。
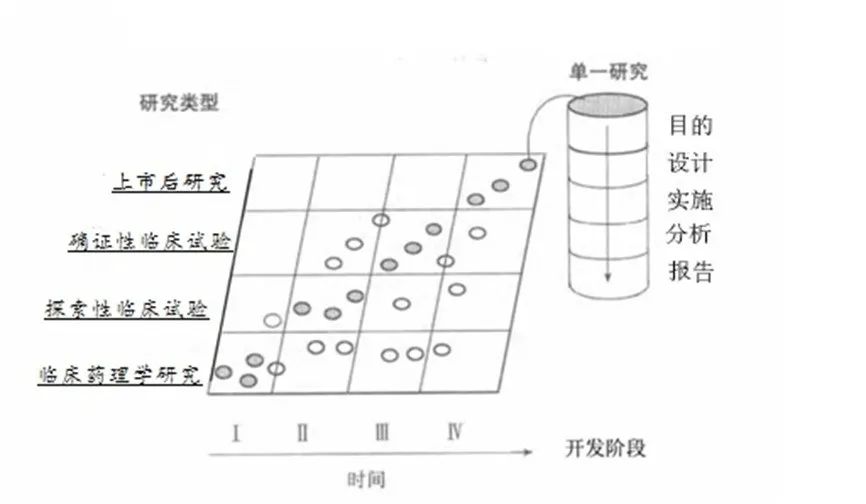
(实心圆代表在某一研发阶段最常进行的研究类型,空心圆代表某些可能但较少进行的研究类型)
● 临床药理学研究的目的是评价耐受性,明确并描述药代动力学及药效学特征,探索药物代谢和药物相互作用,以及评估药物活性。
● 探索性临床试验的研究目的是探索目标适应症后续研究的给药方案,为有效性和安全性确证的研究设计、研究终点、方法学等提供基础。
● 确证性临床试验的研究目的是确证有效性和安全性,为支持注册提供获益/风险关系评价基础,同时确定剂量与效应的关系。
●上市后研究的目的是改进对药物在普通人群、特殊人群和/或环境中的获益/风险关系的认识,发现少见不良反应,并为完善给药方案提供临床依据。
临床试验分期
-
Ⅰ期临床试验:最典型的是临床药理学研究,通常是非治疗目的,可能在健康志愿者或某类患者(例如:轻度高血压患者)中进行。具有显著潜在毒性的药物(例如:细胞毒性药物)通常选择患者作为研究对象。I期研究通常涉及以下一个或多个方面:初始安全性和耐受性评估、药代动力学研究、PK/PD研究、药物活性的早期评估等。
-
Ⅱ期临床试验:最典型的是疗效探索研究,把探索药物治疗有效性作为主要目的,一个重要目标是为III期临床试验确定给药剂量和给药方案。
-
Ⅲ期临床试验:最典型的是治疗确证研究,证明药物对预期适应症和用药人群是安全有效的。Ⅲ期研究的目的在于为获得上市许可提供足够的证据,研究内容涉及剂量-效应关系的进一步探索,或对更广泛人群、疾病的不同阶段,或合并用药进行研究。
-
Ⅳ期临床试验:在新药在获准上市后,对安全性、有效性、和剂量界定的论证,但只涉及批准的适应症。
-
生物等效性试验:生物等效性(Bioequivalence, BE)研究是比较受试制剂(T)与参比制剂(R)的吸收速度和吸收程度差异是否在可接受范围内的研究,可用于化学药物仿制药的上市申请,也可用于已上市药物的变更(如新增规格、新增剂型、新的给药途径)申请。
分期的概念仅是一种描述,而不是一套要求。研究分期的概念并不意味着研究必须按照固定的顺序进行,因为对于某些药物来说,按照典型的顺序进行的研发计划是不适宜或者不必要的。例如:尽管人体药理学研究一般是在I期进行,但在其他III期中也常进行很多此类研究,有时仍会被归入I期研究。
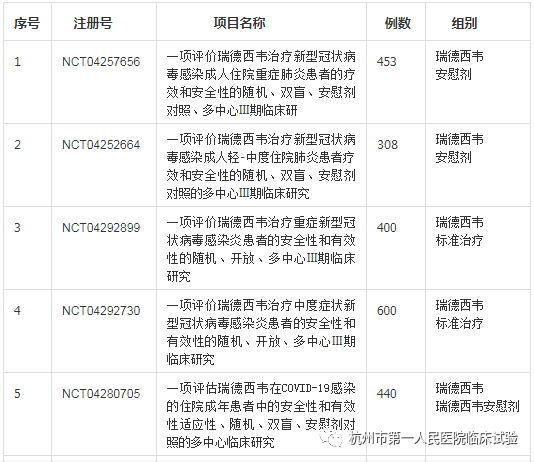
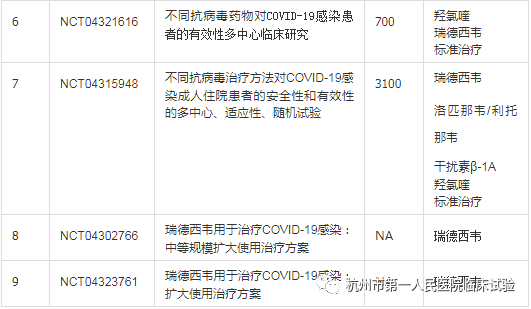
那么谐音为“人民的希望”的瑞德西韦 (Remdesivir)又有哪些正在开展的针对COVID-19临床试验呢?在ClinicalTrials.gov 共登记9项关于瑞德西韦治疗COVID-19的研究(Search Results 04/04/2020),其中2项为同情用药(Expanded Access,Compassionate Use)。由我国中日友好医院发起的2项III期临床试验为双盲安慰剂对照研究,也就是研究者和受试者均不知道用的是瑞德西韦还是安慰剂,试验结果最快在2020年4月27日揭晓。

供稿:叶丽君
审核:王飞
扫描二维码
关注更多精彩

相关阅读
- 04-11 ACS Nano | 杭州市第一人民医院林能明教授团队和浙江大学高建青教授团队揭示仿中性粒细胞纳米载体调节免疫微环境增敏抗肿瘤化疗疗效的作用机制
- 11-14 喜报!市一医院成功获批浙江省工程研究中心!
- 11-14 浙江省老年重大慢病防治中医药重点实验室
- 01-30 【科研诚信教学】转发国家自然科学基金委官方出品学术不端警示教育系列动画
- 11-24 行而不辍,未来可期 ——我院顺利召开国家自然科学基金申报培训会
- 11-17 笃行不怠,踔厉奋发 ——浙大市一举办2022年度国家自然科学基金申报动员会
- 01-06 浙江省临床肿瘤药理与毒理学研究重点实验室
- 01-06 杭州市消化疾病研究所
- 01-06 浙江省中西医结合分子肿瘤学重点实验室
- 12-18 重融合 研精微 致广大 ——肿瘤融合研究与精准诊治实验室正式启用
