【重症风采】连载4 | 当ECMO遇上孕妇羊水栓塞
对于久战未捷,历尽千辛万苦才怀上宝宝的年轻爸妈们,对怀胎十月后,宝宝即将到来的时刻可谓是数九隆冬盼春光,三更半夜盼朝阳。虽然迫不及待,但是福是祸,不到最后一刻,还真难说。因为前面可能还有一头“拦路虎”,那就是人人谈之色变的“羊水栓塞”。
羊水栓塞(Amnionic Fluid Embolism,AFE)是指在孕妇分娩过程中羊水突然进入母体血液循环引起急性肺栓塞,过敏性休克,弥散性血管内凝血,肾功能衰竭或猝死的严重的分娩期并发症(如图1)。发病率为4/10万~6/10万,AFE是由于污染羊水中的有形物质【胎儿毳(cuì)毛,角化上皮,胎脂,胎粪】和促凝物质进入母体血液循环引起。近年研究认为,AFE主要是过敏反应,是羊水进入母体循环后,引起母体对胎儿抗原产生的一系列过敏反应,故建议命名为“妊娠过敏反应综合征”。
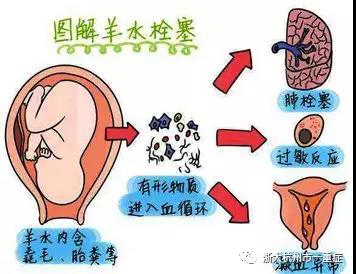

(图1:图片来源于网络)
无论是发达国家还是发展中国家,AFE都是孕产妇死亡的主要原因之一,在孕产妇死亡排序中居第1~3位。当前发达国家的AFE孕产妇病死率为13.5%~44.0%,而在1994年以前为60%以上,存活者中约60%留下了永久性的神经系统损伤。所以生宝宝真是不容易,不仅要孕气十足,还要运气十足!
AFE所致的孕产妇死亡原因主要是心跳骤停、难以控制的大出血、成人呼吸窘迫综合征和多器官功能衰竭。AFE的高危因素有:孕妇年龄≥35岁、剖宫产分娩、引产、急产、多胎妊娠、羊水过多、产钳助产、子宫颈裂伤、前置胎盘、胎盘早剥、子痫前期等。上述只是高危因素并非直接病因,当前学术界的共识是无法通过改变产科处理来预防其发生,AFE的发生仍然是难以预测和预防的。有报道显示,体外膜肺氧合(ECMO)对于AFE患者有一定的效果,下面分享给大家。
摘要:
AFE是一种罕见但致命的产科急症,其特征为突发的心血管衰竭,呼吸衰竭和弥散性血管内凝血(DIC)。我们现报告一例由于AFE而导致心脏骤停,并成功地用V- A ECMO治疗的病例。一名32岁,怀孕39.1周,计划安排引产的女性。分娩时,突然出现全身强直性阵挛,随后出现呼吸困难和低血压。我们直接进行阴道分娩,婴儿健康娩出。尽管对产妇进行了适当的心肺复苏,但她出现了低氧血症并且经历了复发性心血管疾病。随着ECMO的迅速应用,患者情况迅速稳定,并且无任何并发症出现。ECMO似乎是AFE合适的治疗选择。
案例介绍:
一名32岁,妊娠39.1周的女性被送入医院进行诱导分娩。患者曾有一次以自然阴道分娩的方式分娩过,并且未出现并发症。该患者定期进行产前检查,并且她的常规产前筛查检查均正常。她的生命体征正常,没有任何过敏史。用催产素诱导4小时后,将镇痛硬膜外导管插入腰椎,然后连续给予罗哌卡因(7.5mg/mL)和芬太尼(2μg/mL)(4mL/h)。诱导5小时40分钟后宫颈完全打开。在换药时,患者出现全面的强直性阵挛,血压下降至65/45mmHg。同时,新生儿已经娩出;1分钟和5分钟的Apgar评分分别为7和9,脐带残端的血液pH值为7.270。立即给予静注4mg劳拉西泮。她的股动脉非常弱,并且出现呼吸暂停。我们立即进行心肺复苏和气管插管。虽然血压和电节律恢复如初,但发生室性心动过速,然后反复无脉。床旁经胸超声心动图显示,左心室全面性运动功能减退伴严重收缩功能障碍。实验室数据显示凝血酶原时间测不出,活化的部分凝血活酶时间和纤维蛋白水平(如图2)提示出现严重的DIC。卡贝缩宫素是子宫收缩剂,用以控制阴道出血。阴道出血量约为400毫升,呈下降趋势。经阴道超声检查未发现子宫收缩乏力,裂伤或胎盘残留。
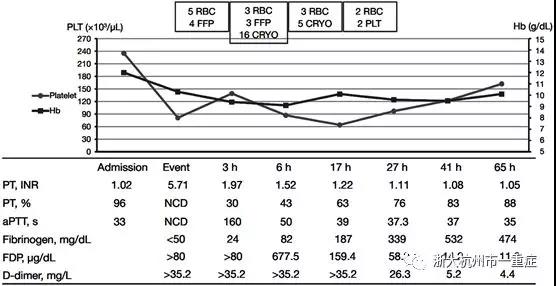
图2:根据实验室结果进行大量输血,包括包装红细胞(11个单位),新鲜冷冻血浆(7个单位),冷沉淀(21个单位)和血小板(2个单位)。显示弥散性血管内凝血的实验室结果持续改善。APTT,活化部分凝血活酶时间; CRYO,冷凝蛋白质; FDP,纤维蛋白降解产物; FFP,新鲜冷冻血浆; Hb,血红蛋白; INR国际标准化比率; NCD,无凝血检测; PT,凝血酶原时间; PLT,血小板; RBC,红细胞
考虑到临界血流动力学状态和可能由AFE引起的严重心脏功能障碍,虽然存在严重的DIC,但利用了体外生命支持。在第一次心脏骤停后1小时,17-Fr动脉和21-Fr通过Seldinger术将静脉导管插入左股静脉。我们使用Rotaflow离心泵®(MAQUET Cardiopulmonary AG, Hirrlingen, Germany)进行了ECPR,未给予例如推注或连续注射肝素等的全身抗凝。初始流速为3.9L/min(总循环的90%),平均动脉压为80mmHg,脉压非常小,表明心脏收缩减少。大部分血管活性药物可以停药,患者的生命体征逐渐稳定。体外膜氧合(ECMO)的流量可降至2.7L/min(总循环的60%),患者在ECMO支持后2小时恢复了意识和定向。在ECMO支持20小时后的后续超声心动图显示左心室收缩功能显着改善。ECMO支持24小时后,弥漫性肺水肿得到改善(图2),并可成功从ECMO撤机。然后第二天病人就成功拔管了。患者在ECMO支持期间,接受11单位的浓缩红细胞(200mL/单位),7单位的新鲜冷冻血浆(200mL/单位),2单位的机采血小板(250mL/单位)和21单位的冷沉淀物(40毫升/单位)(图3)。住院13天后,患者出院时无神经系统遗留疾病和心脏并发症
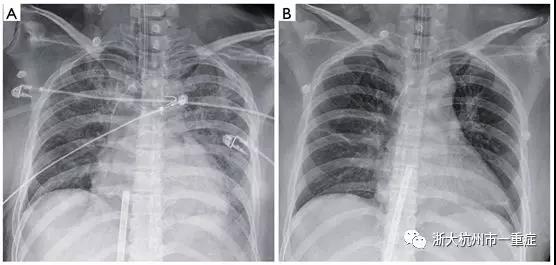
图3:胸部X线显示体外心肺复苏时双侧肺水肿(A) 体外生命支持24小时后肺水肿明显改善(B)
讨论:
根据美国的数据,在分娩过程中产妇的心脏骤停是一种罕见的事件,分娩中发生的概率约为1/12,000。除出血外,AFE是围产期心脏骤停的最常见原因之一,其死亡率相当高,约为50%。AFE的危险因素包括高龄产妇,剖宫产,前置胎盘或早产,多胎妊娠。此外,与该患者一样,医疗诱导分娩似乎增加了AFE的风险。但是,不管有没有这些风险因素,AFE都无法预防或阻止。因此,在鉴别诊断任何怀孕或近期产后患者的心肺猝死时,应考虑AFE。AFE的诊断应基于临床情况,包括经典的呼吸窘迫三联征,心血管衰竭和凝血障碍。AFE的病理生理学尚未完全了解,但由于胎儿物质进入母体循环而在围生期妇女中引发的血液动力学改变的复杂序列,导致促炎介质系统和机械性梗阻的异常激活。作为参考,我们可以展示一名29岁的产后妇女尸体解剖病例的典型病理特征(图4)。结果,肺血管收缩和高血压进展到急性右心室衰竭,然后是左心室衰竭,并且凝血级联被激活。但是,最初的肺动脉高压可能是短暂的,因为严重的左心室功能不全与正常肺动脉压力似乎是一些患者的主要血流动力学变化。在多达80%的病例中存在不同程度的DIC,这些通常表现为出血并发症。
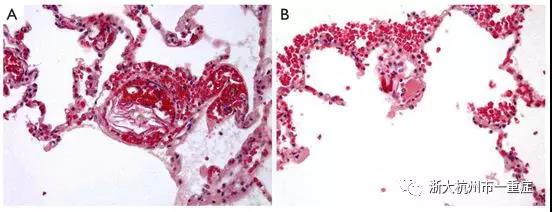
图4:一名29岁女性因分娩期大量子宫出血而急诊剖宫产术后,AFE导致的突然心血管衰竭死亡。存在于肺微循环中的蛋白质样的物质和从胎儿皮肤,胎毛,来自胎儿皮脂的脂肪(H&E×100,A)和来自胎儿呼吸道或胃肠道的粘蛋白(H&E×200,B)是典型的病理特征
如果在分娩前发生AFE心肺衰竭,即刻分娩对于母亲和新生儿的预后都很重要,而且这项操作可以降低缺氧引起永久性神经损伤的风险。如果心输出量尚未有效建立,通过排空子宫来缓解大动脉腔内压迫显着改善了复苏效果。当传统的心肺复苏难以起效时,可以考虑ECPR。然而,在这种情况下,在ECMO期间使用抗凝治疗是一种常见的临床困境,因为重度凝血功能障碍患者的活动性出血可能会恶化。抗凝是治疗V-A ECMO以防止血栓形成和全身血栓栓塞的基石。但是,在ECMO支持期间我们没有使用肝素。根据以前的报道,在AFE患者中使用机械循环支持,所有患者可在2至3天内撤机。因此,我们计划在输血后,DIC和出血得到控制时,再使用肝素。幸运的是,在这种情况下,患者在第二天迅速恢复,并且ECMO成功脱离而没有血栓栓塞事件。
总而言之,AFE是一个不可预测的,威胁生命的围产期事件。复发性心脏骤停和严重的DIC会导致不良后果,但患者实际上可以在几天内恢复。早期和积极的治疗,如ECPR,对挽救母亲和新生儿的生命是非常重要而独特的。


