重症COVID-19患者的急性肾损伤(下)


翻译:刁孟元
急性肾损伤的病理生理学
COVID-19相关的AKI的病理生理学认识尚不清楚。目前的知识提示了非特异性机制,但也有更多的特异性机制,如通过其受体(ACE2)在肾脏中高表达的病毒直接损伤,RAAS失衡,病毒感染引起的亲炎性细胞因子升高和微血管血栓形成(图3)。

非特异性机制
许多因素可能导致AKI的发生,特别是在危重病人中。首先,大多数COVID-19 AKI患者年龄较大,且常伴有高血压或糖尿病等共病(表S1)。这些因素都是众所周知的肾易损性因素。最近,他们被证实是急性呼吸衰竭患者AKI发展的重要因素。此外,由于这些情况,患者经常接受药物治疗,干预调节肾血流,如ACE抑制剂。炎症可能是重要的,因为很多患者经历了长时间的发热、呼吸急促和胃肠问题,这可能导致低血容量和随后的肾前AKI。然而,到目前为止,还没有研究报道入院时的容量状况,我们只能推测这些因素在AKI发病中的作用。肾毒性也可能涉及。用于研究血栓栓塞事件(特别是肺栓塞)的造影介质可能在AKI发病中起作用。肾毒性药物也可能在AKI的发展中发挥作用,特别是抗生素、抗病毒疗法或传统药物。然而,这些因素在COVID-19患者中的研究并不充分。
其次,其他机制可能有助于急性呼吸窘迫综合征(ARDS)患者发生AKI,这是严重SARS-CoV-2感染患者入院的首要原因。气体交换障碍和严重低氧血症被认为是ARDS患者AKI的相关因素。Grasselli等报道了伦巴第地区暴发早期ICU收治的1591例患者中常见的严重低氧血症(入院时PaO2/FiO2中位数为160 [114-220]mmHg)。血流动力学障碍,如中心静脉压升高、胸内压升高或容量过负荷也可导致AKI出现或加重。虽然临床证据较少,但一些生理学研究表明胸内高压和PEEP可影响排尿量和肾小球滤过。
Gattinoni等人认为在COVID-19肺炎早期阶段,肺损伤机制与传统ARDS不同,其表型主要表现为正常肺顺应性、低可复张性和不需要很高的PEEP。换句话说,在COVID-19急性呼吸窘迫综合征的早期阶段,可能不需要高水平且对肾脏不利的PEEP。最后,有创机械通气本身的不良影响,特别是当采用非保护策略时,也可能导致肾损伤。
SARS-COV-2细胞进入肾脏
血管紧张素转换酶2 (ACE2)是ACE的同系物,可将血管紧张素II转化为血管紧张素1-7,减轻肾素血管紧张素系统相关的血管收缩(图4)。ACE2有两种形式:可溶性ACE2和膜结合ACE2。SARS-CoV-2与宿主细胞细胞膜上的ACE2结合。冠状病毒进入细胞依赖于病毒刺突蛋白与细胞受体的结合以及宿主细胞蛋白酶对S蛋白的启动。因此,细胞的侵袭依赖于ACE2的表达,也依赖于蛋白酶TMPRSS2(跨膜蛋白酶,丝氨酸2)的存在,它能够裂解病毒尖峰。在肾脏中,ACE2表达于近端小管和足突细胞的根尖刷边缘。在肾内皮细胞中,只有ACE表达而没有检测到ACE2。最近的人类组织RNA测序数据显示,肾脏中ACE2的表达比肺组织高出近100倍。TMPRSS2也在肾脏中被发现,尤其是在近端小管中。最近,Wang等人发现SARS-CoV-2通过CD147-spike蛋白的新途径侵入宿主细胞。CD147是广泛表达的跨膜糖蛋白,高表达于近端小管上皮细胞和炎性细胞,并参与多种肾脏疾病。
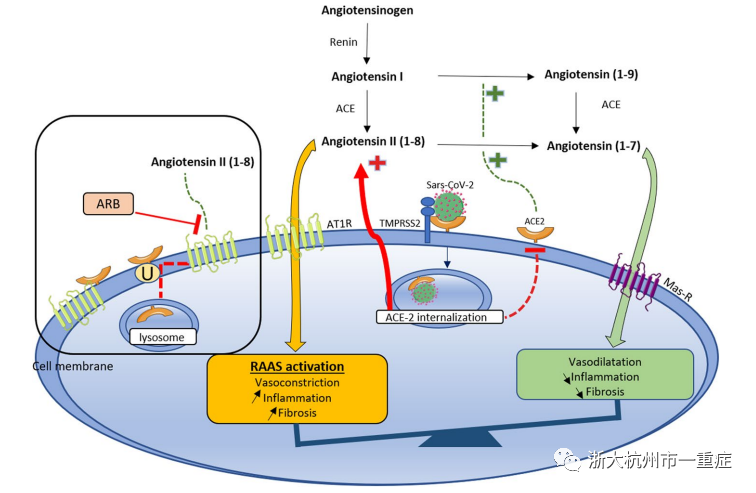
失衡的RASS激活
首先,SARS-CoV-2附着于ACE2并诱导膜结合ACE2的下调,通过减少其降解为血管紧张素1-7,从而促进血管紧张素II的积累。因此,COVID-19介导的血管紧张素II积累可能促进失衡的RAAS激活,导致炎症、血管破裂和血管收缩。
其次,ACE2通常与AT1受体相互作用,形成复合物,阻止膜结合的ACE2内化和降解为溶酶体。血管紧张素II的积累减少了这种相互作用。并诱导泛素化和内化膜结合的ACE2到溶酶体。
RASS抑制剂的作用
由于RAAS的激活以及SARS-CoV-2和ACE2之间的相互作用,一些作者认为RAAS抑制剂可以作为COVID-19感染的潜在治疗手段。相反,其他研究表明ACE抑制剂和ARB可能会增加ACE2的表达,从而增加患者对SARS-CoV-2感染的易感性。然而,膜结合和循环ACE2可能对COVID-19的侵袭性发挥拮抗作用。循环中的ACE2可能作为一个诱饵,阻止SARS-CoV-2进入依赖于其膜结合的ACE2受体的靶细胞。这意味着除了ACE/ACE2平衡外,可溶性ACE2/膜结合ACE2平衡也同样重要。RAAS抑制剂的作用,然后应检查在其潜在的破坏这两个平衡。最近的两项回顾性研究表明,RAAS抑制剂对COVID-19患者具有保护作用。在第一项包括1128名高血压患者的回顾性研究中,作者观察到接受ACE抑制剂/ARB的患者全因死亡率降低。在第二项研究中,一个小的回顾性队列,使用RAAS抑制剂与较低的危重病人比例和较低的死亡率相关。
最近的临床研究表明,RAAS抑制剂与COVID-19或死亡风险之间缺乏相关性。到目前为止,心血管学会因此建议不要添加或停止RAAS抑制剂。
细胞因子在COVID相关性AKI中的作用
越来越多的证据表明,重症COVID-19患者的炎性细胞因子水平升高,尤其是当他们被收住ICU时。黄等人研究发现白介素-1β(IL-1β),IL-1RA,IL-7,IL-9,IL- 10, 纤维母细胞生长因子(FGF),粒细胞巨噬细胞集落刺激因子(GM - CSF), 干扰素-γ(IFNγ),粒细胞集落刺激因子(G - CSF),干扰素-γ-诱导蛋白质(IP10),单核细胞化学引诱物蛋白质(MCP1),巨噬细胞炎症蛋白质1α(MIP1A),血小板源生长因子(PDGF),肿瘤坏死因子(TNFα),血管内皮生长因子(VEGF)的表达水平增加。其中危重患者IL-2、IL-7、IL-10、G-CSF、IP10、MCP1、MIP1A、TNF-α的含量较高。这些细胞因子可能参与COVID-19患者的AKI,通过与肾细胞相互作用,诱导内皮和肾小管功能障碍。例如,TNF-α可直接与管状细胞受体结合,触发凋亡的死亡受体途径。其他研究也发现,COVID-19危重患者的IL-6水平升高,而非存活组患者的IL-6水平与存活组相比升高。IL-6的有害作用已在不同的AKI模型中得到证实,包括缺血性AKI、肾毒素诱导的AKI和脓毒症诱导的AKI。在肾毒素诱导的AKI模型中,TNF-α-/-小鼠和IL-6-/-小鼠对AKI表现出相对耐受。IL-6还可引起肾血管通透性增加,肾内皮细胞(IL-6、IL-8和MCP-1)分泌促炎性细胞因子/趋化因子,并可能参与微循环功能障碍。因此,我们可以推测这些细胞因子可能参与了COVID-19患者的AKI。然而,细胞因子的升高是中度的(在我们的ICU队列中,IL-6的中位值为79 pg/ml (39-135 pg/ml)(未发表数据),而过炎症反应的ARDS(IL-6的中位值为1568 pg/ml;517-3205 pg/mL),脓毒症(IL-6中位数为1346 pg/mL;(292-8789 pg/mL)或细胞因子释放综合征中白细胞介素-6的中位值可能接近10000 pg/mL。此外,COVID-19患者细胞因子的升高是否会转化为免疫调节策略的有益效果尚不清楚。
血栓形成在COVID相关性AKI中的作用
一些作者报道了COVID-19患者急性血栓事件的高发,主要是静脉血栓形成和肺栓塞。Helms等发现,因SARS-CoV-2感染而入院的危重患者中有16.7%出现肺栓塞。有趣的是,COVID-19 ARDS患者比非COVID-19 ARDS患者表现出更多的血栓性并发症。在肾脏,肾小球环中纤维蛋白沉积的存在有利于凝血稳态的失调,可参与肾微循环功能障碍和AKI。Tang等在一项回顾性研究中证实,预防性抗凝治疗可降低COVID-19患者的死亡率。然而,目前还没有关于抗凝治疗对肾脏预后影响的数据。SARS-CoV-2感染期间肺栓塞的高发生率和随后的右心衰也可能导致静脉充血和AKI的发展。
COVID-19相关AKI的治疗
到目前为止,COVID- 19相关的AKI还没有专门的治疗方法。正在研究一些治疗COVID-19的研究药物。然而,没有控制数据支持使用任何特殊治疗(抗病毒药物或免疫调节药物),它们对COVID-19的疗效仍不清楚。关于RRT,没有数据支持在脓毒症中使用不同的策略。因此,RRT的时机、模式(间歇与连续)和剂量可能依赖于非COVID-19数据。值得注意的是,Helms等人发现RRT期间滤器凝血的发生率很高(特别是在持续静脉-静脉血液滤过期间,高达96.6%的滤器凝血)。如果可能的话,枸橼酸局部抗凝(除了全身抗凝外)应该是首选。如果没有,应特别注意给予高效的肝素抗凝。
到目前为止,没有证据表明在脓毒症诱导的急性肾缺血发作期间使用RRT去除临床重要的细胞因子,也没有COVID-19设置的数据。
如果在ICU出院时出现持续性蛋白尿或血尿,COVID-19患者可从肾病学家的随访中获益。
结论
AKI在COVID-19重症患者中普遍存在。肾脏受累与预后不良有关。几种机制可能参与SARS-CoV-2感染期间肾损伤的发生,包括SARS-CoV-2直接入侵肾实质,RASS失衡和微血栓形成,此外还包括继发于血流动力学不稳定的肾损伤,炎症细胞因子和用于ICU治疗的并发症(肾毒性药物,机械通气)。对肾脏变化的早期发现和特殊治疗,包括充分的血流动力学支持和避免使用肾毒性药物,可能有助于改善COVID-19危重患者的预后。

相关阅读
- 09-13 第八期“浙大市一.临床大讲堂”预告
- 05-24 2021年第三届湖畔眼底病高峰论坛暨浙江省级继续医学教育项目《玻璃体视网膜疾病诊疗进展》圆满举办
- 10-29 COVID-19流行期间重症监护中的床旁肺部超声
- 10-29 肝硬化患者的自发性细菌性腹膜炎和腹膜外感染(上)
- 10-20 妊高症回顾(上)
- 10-20 妊娠期高血压疾病与心血管疾病相关发病率和死亡率的系统评价分析
- 10-07 急性心梗后超声可发现的机械性并发症
- 10-07 做了一回赵半仙--高血压心脏病
- 10-07 综合生命支持降低暴发性心肌炎死亡率的多中心研究(上)
- 10-07 经鼻雾化吸入(上)
