【重症风采】连载46 | ARDS的体外支持策略(下)

急性呼吸窘迫综合症的体外支持策略
翻译:未亚平 编辑:李沂玮

![]()
![]()
ECLS的适应症和禁忌症
![]()
![]()
VV-ECMO可能适用于保护性通气的严重ARDS患者,即使我们采用了俯卧位通气、神经肌肉阻滞剂及优化PEEP等方法,患者仍有以下表现之一:(图2)
1.PaO2/FIO2< 50mm Hg大于 3小时。
2.PaO2/FIO2 < 80mm Hg大于 6小时。
3.pH < 7.25或PaCO2> 60mm Hg大于 6小时。
患者的选择是ECLS成功的最关键因素。对预后指标或评分的评估可能有助于决定哪些患者将从这项技术中获益最多。预后不良的相关因素包括高龄、免疫功能低下、ECMO前住院时间和机械通气时间、高吸气压力(峰压和平台压)、碳酸氢盐输注、严重高碳酸血症、一氧化氮使用、神经损伤、心脏骤停、高胆红素血症、肾功能衰竭、低血压、高乳酸血症、酸中毒、血小板减少和器官衰竭。预后较好的相关因素包括吸入性肺炎、流感肺炎、ECLS前使用过神经肌肉阻断剂和俯卧位通气。(表3)
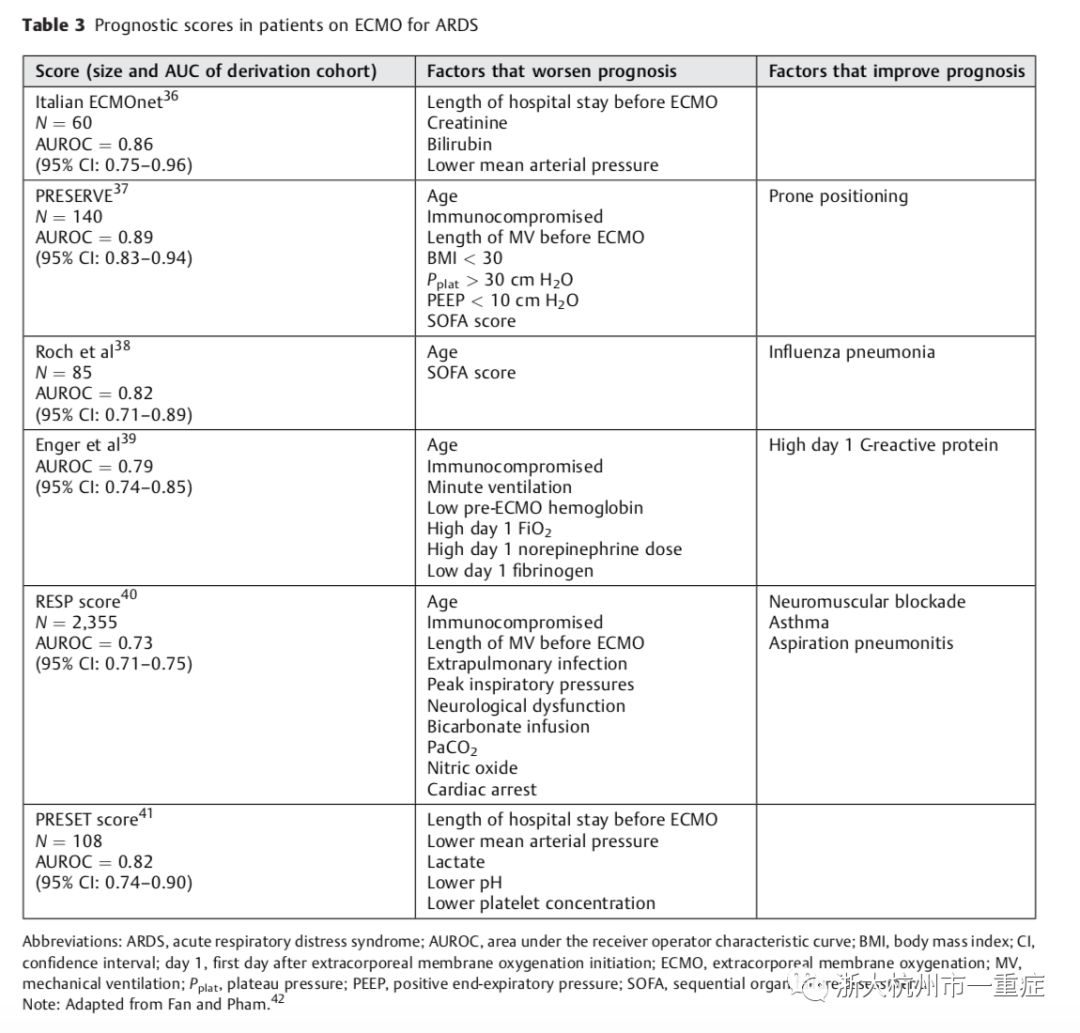
ECLS是一种有限的资源,因此不应在无意义的条件下使用。包括不可逆转的灾难性脑损伤、已确定的多器官功能衰竭、终末期慢性疾病或短期预后不良的潜在疾病,如转移性癌症患者。其他常见的禁忌症包括7天以上高压有创机械通气、高龄、活动性出血、以及抗凝禁忌症。
![]()
![]()
ECLS的并发症
![]()
![]()
管路的置入是ECLS成功的关键性因素。导管的选择和放置是ECLS疗效的关键决定因素。插管应在最理想的条件下进行,使用相应的设备,并由经验丰富的人员进行操作。理想情况下,管路置入的操作者应在另一个负责血流动力学和通气管理的个体协助下进行。ECSL可能发生多种危及生命的并发症,如血管穿孔合并内出血和右心房或心室穿孔合并填塞。在维持阶段,电路和病人相关的并发症均可能发生。
在ELSO 登记中,10%接受ECMO治疗的成人呼吸衰竭患者发生了插管部位出血。常见的亚急性管路相关并发症包括血小板减少(27%)、溶血(5%)和弥漫性血管内凝血(3%)。氧合器故障(6%)需要紧急更换氧合器,最常见的是与之前的警告信号有关,如膜后PaO2降低和跨膜压力增加。罕见的危及生命的管路相关并发症包括管路破裂导致的大量失血、空气栓塞、血栓栓塞、泵血栓或停工,以及意外脱出。将管路的复杂性降到最低,并对ECMO团队进行模拟培训,有助于预防这些并发症。出血是最常见的并发症。最近的一项荟萃分析指出,3%接受VV-ECMO治疗的ARDS患者大出血率为19%,需要大量输血。EOLIA试验指出,VV-ECMO显著增加了出血率并需要输血治疗 (þ18%; 95% CI: þ6 to þ30%)。根据ELSO登记系统,因呼吸衰竭而予以ECMO支持的患者中,有6%的患者出现消化道出血,4%的患者出现肺出血,3%的患者出现颅内出血(ICHs)。VV-ECMO患者发生ICH的原因是多因素的,其发病机制与其潜在的疾病密切相关。深静脉血栓形成(DVT)在接受ECLS的患者中也很常见。经过系统筛查后发现VV-ECMO后患者DVT发生率高达85%。
它发生似乎与ECMO期间抗凝目标无关,双腔管越大,发生率越高。
VV管路的使用使临床医生避免了与动脉插管相关的并发症,如动脉出血、肢体缺血和假性动脉瘤的形成。与VV-ECMO相比,VV-ECCO2R的套管更小,因此理论上导致的管路相关并发症更少。
然而,这一点仍有待证明。另一方面,ECCO2R的低血流量增加了膜肺中血液的运转时间,增加了膜肺血栓形成的风险。因此导致了对抗凝剂需求的增加,以保持管路的通畅。随着ECCO2R的降低,氧和能力可能下降,因为潮气量的减少可能导致更多的肺不张,但这可以通过增加PEEP来预防。随着全球VV-ECCO2R经验的积累,我们将更好地了解其适应症和并发症。
![]()
![]()
VV-ECLS期间的患者管理
![]()
![]()
止血
血液与非内皮细胞的体外循环管路接触继而激活凝血系统。因此需要抗凝以防止血栓形成。血液与管路的相互作用还可导致消耗性凝血病、纤溶和补体途径的激活、血小板功能障碍和消耗。在血栓形成的管路可发生纤溶亢进,但矛盾的是会导致导致病人出血。
关于ECLS期间止血的最佳管理,缺乏严谨的数据。普通肝素是应用最广泛的抗凝剂。它通常是由开始置管时的50到100U/kg 注入,
然后按照7.5到20U/kg/h泵入 。输注量通常是滴定,以达到特定的个体化目标。
肝素药代动力学和药效学是高度可变的,因为其相对不加区别的与蛋白质和细胞结合,可以通过各种机制(包括内皮细胞和巨噬细胞代谢)被消除,也可通过抗凝血酶III发挥其作用,但抗凝血酶III在ECLS患者中往往有缺陷。用于监测凝血的参数及其目标值仍不确定。测定抗凝血的常用参数包括活化凝血时间(ACT)或活化部分凝血活酶时间(APTT)。ACT的目标一般在160到200s 之间,这与ELSO建议的180到220s 相似。APTT目标通常在40到60s 之间。少数中心监测粘弹性试验(血栓弹性描记法、旋转血栓弹性测量)和肝素浓度。一半的中心监测抗凝血酶III,一般目标为50 - 99%。血小板计数在100 *109/L以上的患者给予乙酰水杨酸治疗。对多个参数进行监测,以低水平抗凝为目标,积极补充循环中消耗的血制品,可能有助于预防血栓形成和出血并发症。联合监测抗Xa因子、粘弹性和抗凝血酶III的抗凝血方案的实施可减少血制品的输注并降低出血并发症。在最近的回顾性队列研究中,与类似的队列相比,低抗凝目标(APTT: 40-60s )与较低的出血并发症发生率相关。由于ICH的发生与血小板减少和纤维蛋白原下降相关,在获得更多数据之前,相对宽泛的血小板和冷沉淀输注阈值可能是合理的。值得注意的是,除非患者出现“严重”血小板减少并引起出血,否则EOLIA不鼓励输血。该策略与需要输血的高出血率和低脑出血率有关。
![]()
![]()
VV-ECLS期间的机械通气
![]()
![]()
ECLS除了能够挽救严重的气体交换异常患者之外,其在ARDS治疗中主要的获益是能够预防进一步的VILI。事实上,在最近一项关于VV-ECMO期间机械通气的调查中,绝大多数受访者表示其治疗目标为“肺休息”(77%),只有18%报告为“肺复张。然而,促进肺休息和愈合的最佳条件仍不确定。在近期的两篇关于VV-ECMO的 RCT中,也降低了ECMO组机械通气的强度,吸气压力≤25 cmH2O, PEEP为10 ~ 15cm H2O, FiO2为30 ~ 50%。在近期的一篇综述中指出,VV-ECMO使潮气量(Vt)从6.1 mL/kg 降至3.9mL/kg PBW, Pplat从32 cm H2O降至25cm H2O, PEEP从14 cm H2O降至12 cmH2O, FiO2从0.99降至0.40。在ECCO2R研究中,PEEP增加而FiO2没有变化。大多数中心的研究中,使用的是控制通气模式62%)与中等水平的PEEP(6-10 cmH2O)。
相关数据和观察研究为我们了解机械通气参数与患者预后之间的关系提供了一些参考。在对一组使用VV-ECMO治疗的H1N1甲流患者的回顾性多变量分析中发现,ECMO第1天Pplat越高,死亡率越高(odds ratio [OR]: 1.33; 95% CI: 1.14–1.59).ECMO的驱动压越大,死亡率也越高。最近的一个使用VV-ECMO治疗ARDS的动物模型对传统肺保护通气(Vt为6 ml/kg,RR为20次/分)与近窒息通气进行了比较。(Vt的音量控制6毫升/公斤和RR每分钟20次)附近窒息通气(压力控制为1:1,驱动压力为10cmH2O,平均Vt为2ml /kg, RR5次/分)。两组的PEEP均设置为10cmH2O。近窒息通气与减少肺组织损伤和早期纤维增生有关。另一项动物研究发现,较低的RR可降低全身以及肺部的炎症。在VV-ECMO中,肺氧合或肺容量的维持无需依赖PEEP,但肺不张对VV-ECMO患者肺愈合的影响尚不清楚。在动物模型中,肺泡缺氧与血管渗漏和巨噬细胞活化有关,但在VV-ECMO期间,肺不张的肺泡部分氧分压是可以维持的。ECMO支持的前3天较高的PEEP与死亡率降低相关(OR: 0.75; 95% CI: 0.64–0.88).而在另一组中,平均PEEP较高与存活率降低相关。
只有27%的中心的VV-ECMO患者使用自主通气模式。这可能是因为ARDS患者很难实现“安全”的自主呼吸,甚至是ECMO患者。由于ARDS的呼吸驱动力高,在自主通气过程中,患者自身可能造成的肺损伤越来越受到关注。当气流量增加时,健康个体的分钟通气量会呈比例下降。相比之下,ARDS患者要复杂得多,在大多数患者的呼吸驱力被抑制之前,总VCO2的很大一部分必须由膜肺来处理。此外,即使VCO2.ML很高,潜在的具有伤害性的跨肺压也可能持续存在。在Crotti等人最近的一项研究中,只有27%的ARDS患者可以实现自主呼吸。此外,虽然部分的CO2清除(占总CO2产量的59%)可以缓解COPD患者的症状,但ARDS患者需要全部CO2清除(占总CO2产量的>90%)才能缓解症状。事实上,50%的ARDS患者即使在VV-ECMO上最大限度地清除CO2,症状也没有达到缓解。缓解定义为RR≤ 10和食管压力波动≤8 cmH2O。高水平的二氧化碳清除,动脉氧合减少和分流率增加可能是由于肺泡换气不足和肺塌陷。能够实现自主呼吸的患者一般氧合较好,器官功能障碍及肺损伤较轻。但都需要高水平的PEEP支持。事实上,在ECCO2R支持的ARDS动物模型中,将辅助通气与保护性控制通气(Vt 3 mL/kg)相比较,超保护性机械通气(Vt为3 mL/kg),发现辅助通气可导致更多的组织学损伤和炎症反应。
俯卧位通气已成功应用于VV-ECMO患者。它似乎是安全的,并可能改善肺的氧合和顺应性。它主要用于难治性低氧血症患者和难以脱机的患者。但在ECLS期间俯卧位通气的最佳时机和适应症仍然不明确。FiO2的设置应尽可能降低,以避免氧中毒。PaO2的波动主要通过体外循环来控制。动脉血氧饱和度降低的原因包括CO增加、氧耗增加、ECBF降低、循环增加、膜肺功能下降,自身肺功能下降比较少见。可根据膜前和膜后血气来鉴别。酸中毒在VV-ECMO中很常见,并与死亡率增加有关。EOLIA的PaO2目标为65 ~ 90mm Hg。许多中心输送氧气的比例恒定在1,并通过调整ECBF滴定所需的PaO2。
在ECLS启动前,常伴有高碳酸血症,ECMO启动时PaCO2的大幅下降可能导致脑血管收缩,从而导致脑组织氧供减少。开始时应使用低气流量来缓慢纠正高碳酸血症,并应立即降低自身肺的分钟通气量。EOLIA的PaCO2目标值为<45mm Hg。
在VV-ECMO中伴有气管切开的患者中有很大的差异,其中46%的患者在巴黎,只有4%在墨尔本。在118名接受AV-ECCO2R、VV-ECMO和VA-ECMO治疗的人群中,只有5名(4%)患者在经皮扩张气管切开术后伴发了严重并发症。其中,两例患者伴发大出血,两例患者出现了气胸并需要引流,一例患者在注射镇静剂后出现严重的低血压。Dimopoulos等人指出65例VV-ECMO患者中有10例(15%)在经皮气管切开术后48小时内伴发了相对更多的主要并发症。这一较高的发生率主要是由大出血(n= 7)和更换管路(n=5)引起的。主要并发症患者ECMO支持时间增加,但死亡率无差异。大多数患者在手术前4至12小时停用肝素,术后48小时APTT比值中间值为1.2。研究发现主要并发症的重要危险因素是膜后PaO2值。一种可能的解释是,高强度的限制性抗凝策略导致膜肺内形成更多的血栓,随之而来的是需要更换管路,而膜肺血栓引起的纤溶亢进和消耗性凝血病导致更多的出血并发症。最后,也有报道指出在对有颈内静脉双腔管的患者行气管切开术时伴发了致命的空气栓塞,但这似乎是一个罕见的病例。
ECMO的清醒拔管在一些特定的ARDS患者和单纯因肺损伤而无法耐受无创通气的患者中似乎是可能的。但正如上所述,这是非常困难的。在最近的一项采用优先终止机械通气方案中,只有13%的ARDS患者能够拔管或不插管。
![]()
![]()
液体管理
![]()
![]()
随着ECLS的启动,患者常有明显的炎症反应导致了血管舒张和毛细血管渗漏。这可能导致静脉压力降低和静脉结构的间歇塌陷,间歇性影响引血端的血流循环,从而导致ECBF不稳定。因此我们有时会在置管后24至48小时内给予大量液体,以维持体外循环有足够血容量。然而,ECLS第3天液体正平衡与VA和VV-ECMO患者存活率下降有关。同样的,负平衡与VV-ECMO和CRRT患者肺顺应性改善和生存率提高有关。避免抖管而不给太多的液体的一个方法是降低泵的速度,因此静脉端的引流压力是负值。即使这会导致ECBF较低,但仍是可能维持足够的氧供。同行我们还应检查管路的位置是否正确。然而,有时液体的输入和潴留是不可避免的。在这种情况下,我们应该主动的减轻液体负荷。如患者对利尿剂反应不佳或明显肾功能衰竭,可在接下来的几天内使用利尿剂或持续肾脏替代治疗。
![]()
![]()
镇静和运功
![]()
![]()
ECLS患者的镇静镇痛管理,因其严重的病情和体外循环改变了药物的药代动力学特性而变得复杂。所有药物的分布体积都增加了,亲脂药物的清除率也因管路的隔离而增加。在ECMO开始时镇痛镇静药物剂量会显著增加,终止时则显著减少。最近的一项国际调查发现,在VV-ECMO的前48小时,镇静作用最常是通过持续泵入具有深度镇静作用的咪达唑仑来实现的。咪达唑仑是一种高亲脂性苯二氮平类药物,具有明显的管路隔离作用,相比而言,更推荐丙泊酚用于危重患者机械通气的镇静。咪达唑仑的优先使用可以用丙泊酚脂质制剂可能有堵塞膜肺的风险来解释。然而,在一项小规模的回顾性研究中发现,丙泊酚与膜肺寿命的缩短无关。输注丙泊酚的时间长短,而不是剂量,与氧合器失效的风险有关。将丙泊酚直接注入循环管路(膜前)也会增加风险。VV-ECMO患者最常用的镇痛药是芬太尼。使用吗啡可能是有道理的,因为它的浓度似乎没有被ECMO管路显著改变。
积极的物理治疗可以在ECMO患者中安全实施。同时可能改善VV-ECMO支持的ARDS患者结局。双腔套管的使用促进了患者的活动和行走,对股静脉置管的患者来说是可行和安全的。在一项国际调查中,84%的中心报告予以VV-ECMO患者物理治疗,但只有41%的患者在最初48小时内接受过物理治疗。所有的研究中心都让患者在床上接受了被动运动锻炼的物理疗法。22%实施物理治疗的中心对患者进行了离床活动(需要三到五名人员陪同的步行)。
![]()
![]()
VV-ECMO撤机
![]()
![]()
大多数医疗中心(84%)在呼吸机脱机前VV-ECMO已撤机。当患者自身肺功能在临床和影像上有改善时,我们可以启动ECMO的撤机。肺顺应性的改善通常是肺部好转的早期迹象。最常见的撤机方法是降低气流量。VV-ECMO的撤机试验通常是将气流量调为0,同时至少1小时内保持ECBF > 1.5 L/min (如果耐受的话)。如果患者在调整呼吸机的情况下仍出现氧饱和度降低或呼吸频率过快,则撤机试验失败。或者,可以测动脉血气。不同医疗中心对撤机的准备不同。在没有肺心病的情况下,EOLIA采用PaO2 > 70 cm H2O, FiO2 < 60%, Pplat < 30 cm H2O的策略。关于成功撤机的最佳方法,以及ARDS患者是否应优先行ECLS撤机或停用机械通气仍需进一步研究。
![]()
![]()
ECLS项目的机构
![]()
![]()
VV-ECMO目前仅适用于严重的ARDS患者,发病率每年每百万人中不到5至10例。由于此类疾病的发生率较低,建议在区域和国家的一级组织提供ECMO治疗,以便大容量医疗中心经验丰富的临床团队为其提供治疗。研究表明,每个中心每年至少应开展20例VV-ECMO病例,促进其专业水平的发展。对于不能快速转至ECMO中心的医疗机构,可以在转诊中心的监督下,可以培训一个流动的ECMO团队进行插管和启动,直到转运至最近的ECMO中心为止。
因此,应在三级转诊医院的ECMO中心的周围建立地方、区域和区域间各级医院网络。为了最大限度地提高ECMO中心的效率和工作人员的专业技能,应在同一中心设立呼吸衰竭和心衰的ECMO项目。
工作人员应不断接受ECMO理论和实践方面的培训,并应不断对整个项目进行评估,以确保质量。
![]()
![]()
成本效益
![]()
![]()
在评估VV-ECMO与肺保护性通气对成年ARDS患者的成本效益时,使用VV-ECMO可延长5.2年的生命周期和4.05年的质量调整生命(QALYs)。尤其,在接受VV-ECMO的治疗组中,短期存活率更高,这导致了两组间长期存活率的差异。这是在额外的$145 697CAD寿命费用和每QALY的增量成本效益比$36 001的情况下完成的。
与世界卫生组织可接受的人均国内生产总值三倍的成本效益阈值(许多发达国家,每QALY约为10万美元)相比,有106个VV-ECMO符合标准。当在高容量医疗中心使用时,VV-ECMO的成本效益最大;相关研究数据表明,经验较少的中心,VV-ECMO量较低,死亡率较高。因此,VV-ECMO的使用可能仅限于专业的高容量医疗中心。虽然VV-ECMO对年轻的成人ARDS患者具有成本效益,但当用于老年和较虚弱或那些康复机会较低的危重患者时,成本效益会降低。
![]()
![]()
结论
![]()
![]()
在过去的十年中,ECLS在成人ARDS患者管理中的应用显著增加。
它的主要好处是在肺功能恢复的过程中可以支持患者进行气体交换,而不需要有创伤的高参数机械通气支持。VV-ECMO适用于严重ARDS肺保护性机械通气患者,即使采用俯卧位通气、神经肌肉阻滞剂及优化PEEP等方法,患者仍伴有难治的低氧血症或高碳酸血症。尽管ECLS的应用在迅速扩大,但关于ECLS的治疗管理的最佳方法,如抗凝、输血和ECLS时的机械通气等许多基本问题仍然没有得到解答。最后,ECCO2R在ARDS患者管理中的确切作用还有待确定。近期完成和正在进行的临床试验可提供更多的数据。
原文链接:链接: https://pan.baidu.com/s/1I36uihsQ2jQsoiWIq-obSw 提取码: hct4 复制这段内容后打开百度网盘手机App,操作更方便哦

相关阅读
- 11-10 【党支部靓晒】综合3支部:重症医心 温暖有我
- 11-11 准妈妈ICU昏迷一个月,医生:一直隐藏的秘密终于泄露了......
- 10-29 COVID-19流行期间重症监护中的床旁肺部超声
- 10-29 肝硬化患者的自发性细菌性腹膜炎和腹膜外感染(上)
- 10-20 妊高症回顾(上)
- 10-20 妊娠期高血压疾病与心血管疾病相关发病率和死亡率的系统评价分析
- 10-07 经鼻雾化吸入(上)
- 10-07 经鼻雾化吸入(下)
- 10-07 重症患者AKI的生物标志物
- 10-07 重症患者发生AKI增加死亡率?
