综述:急性胰腺炎并发急性呼吸窘迫综合征(上)


翻译:林华鹏 编辑:李沂玮
前言
急性胰腺炎(AP)是一种胰腺的炎性疾病,可引起多种促炎介质的释放,如酶原、细胞因子和各种血管活性物质,引起全身炎症、内皮功能障碍、血管通透性增加和器官衰竭。尽管大多数患者仅为轻度急性胰腺炎(80%),但仍有10%至20%的患者会出现中度或重度急性胰腺炎,并伴有各种危及生命的局部和全身并发症。器官衰竭的出现是急性胰腺炎患者死亡的主要原因之一。急性胰腺炎的发病率在全球范围内呈上升趋势,但死亡率无明显变化。近年来,各种微创和腹腔镜技术用于治疗急性胰腺炎引起的各种局部并发症显著增加,从而改善了这部分患者的预后。尽管器官衰竭仍然是急性胰腺炎患者死亡的主要原因,但各种器官衰竭的治疗策略在过去几年中几乎没有显著进展。
急性呼吸窘迫综合征(ARDS)以各类炎性反应引起肺间质和肺泡水肿为特点。ARDS的柏林定义是目前公认的定义,它根据Pao2/Fio2比值定义了从临床到新发呼吸症状、胸部X线表现和ARDS严重程度的具体时间范围(表1)。ARDS并非一种原发性疾病,而是各种直接和间接呼吸道损伤的最终结果。肺炎和吸入性损伤仍然是ARDS的主要直接原因,而脓毒血症、严重烧伤和胰腺炎则是ARDS的主要间接原因。尽管各种疾病的预防和管理策略有所发展,但ARDS的发病率和死亡率仍无明显得到改善,是当今面临的一大挑战。缺乏有效的预测因素和预防策略仍然是改善ARDS患者预后的主要原因。
表1.

在这篇综述中,我们将讨论急性胰腺炎患者的ARDS流行病学、病理生理学、预测、预防和管理。
ARDS并发急性呼吸道窘迫
根据器官衰竭、局部和全身并发症的存在和持续性,改良的亚特兰大分类法将ARDS分为轻度、中度和重度。心血管、肾和呼吸衰竭是AP严重程度分层的重要因素。改良的Marshall评分系统对AP器官功能衰竭的严重程度进行定义和判断。根据改良的Marshall评分,呼吸衰竭的定义要求Po2/Fio2比值小于300(得分≥2);他们将严重程度评分2、3和4分别定义为Po2/Fio2比值在201-300、101-200和≤100。虽然改良的Marshall评分已经定义了呼吸衰竭的标准,但是否是可治疗的病因,如胸腔积液、肺不张、肺水肿或ARDS引起的呼吸衰竭还没有具体说明。根据柏林的定义,应在7天内出现呼吸系统症状。但是,对于因局部并发症而导致的迟发性器官衰竭的AP,该标准可能不成立。尽管ARDS是AP中最常见的呼吸衰竭原因之一,且与高死亡率相关,但柏林定义尚未在AP中得到明确验证。因此,AP中ARDS的理想定义需要修正Marshall评分和Berlin评分。它需要大规模的多中心前瞻性研究,以更好地定义和理解AP中的ARDS。
多项研究表明,呼吸衰竭是急性胰腺炎最常见的器官衰竭。Schepers等人研究报道了639例AP患者中有240例发生器官衰竭。呼吸衰竭是该研究中最常见的器官衰竭类型(92%),死亡率为37%。这是AP早期和晚期最常见的器官衰竭类型。此外,在多器官衰竭患者中,呼吸衰竭是最早出现并持续时间最长的。在这项研究中,呼吸衰竭持续19天,而肾衰竭持续10天,心血管衰竭持续7天。同样,Johnson和Abu Hilal的一项研究表明,呼吸衰竭是AP患者最常见的器官衰竭类型。在这项研究中, 13.8%的患者最终死亡,87%的患者出现呼吸衰竭——单器官或多器官衰竭。Karakattu等人对813120例急性胰腺炎住院患者进行回顾性分析,其中急性呼吸衰竭21415例(2.63%),病死率17%。在他们的研究中,年龄>80岁、感染性休克、急性肾损伤、弥散性血管内凝血、需要机械通气或加压素是死亡率的独立预测因素。
发病机制
AP诱导的ARDS的发病机制还不完全清楚(图1)。然而,尸检研究表明,AP诱发ARDS的发病机制与其他原因所致的ARDS并无不同。AP胰腺损伤引起多种细胞因子和炎症介质的释放,导致全身炎症反应综合征的发生,最终导致多种器官功能衰竭。ARDS的肺损伤可分为三个阶段:渗出期(Ⅰ期),弥漫性肺泡损伤,微血管损伤,Ⅰ型肺细胞损伤,肺血管通透性增加,肺水肿;增殖期(Ⅱ期),Ⅱ型肺细胞增生,肺修复,在损伤后7-14天左右发生;在纤维化阶段(III期),急性炎症细胞溶解和纤维化发展。
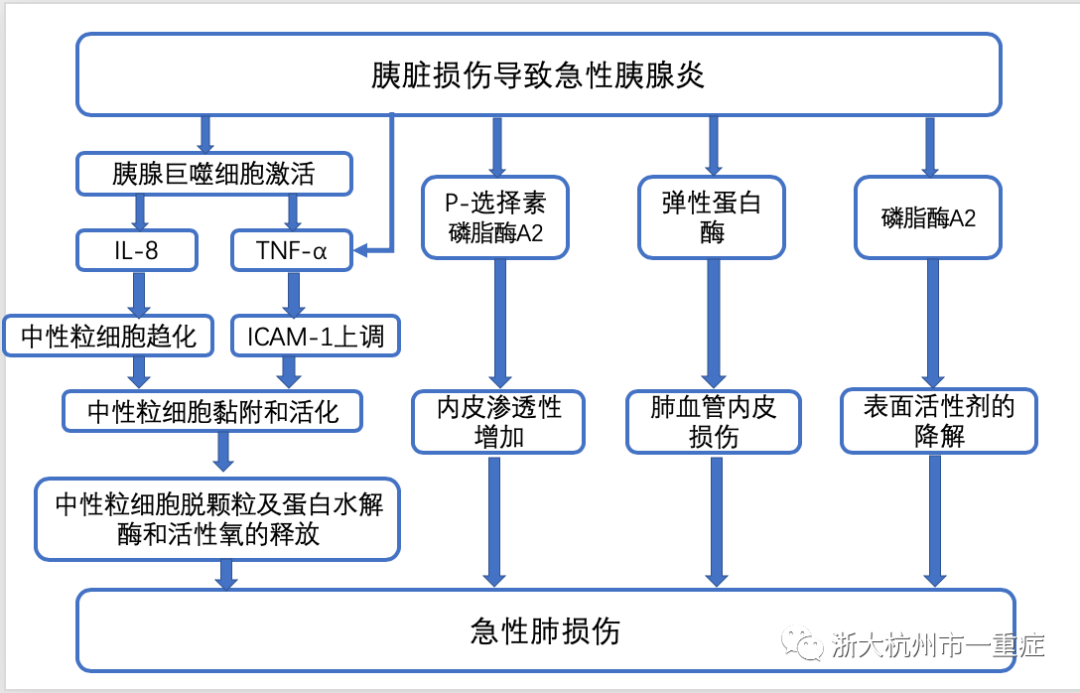
由于胰腺损伤,胰蛋白酶被释放,直接对肺血管造成损伤,通透性增加。更重要的是,胰蛋白酶能激活磷脂酶A2等其他介质和多种补体因子,在ARDS的发生发展中也起重要作用。肺表面活性物质是磷脂酶A2的主要底物之一。研究表明血清磷脂酶A2水平与肺损伤程度相关。此外,血清胰源性和胰外源性磷脂酶A2水平与肺损伤评分相关。血小板活化因子(PAF)是一种有效的生物介质,能促进白细胞迁移。在实验模型中,发现胰腺、腹水和肺中PAF均升高。Lexipafant,一种强大的PAF抑制剂,在AP患者中也显示出一些有益的作用。肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)也是AP早期发生炎症反应的重要介质。它会引起炎症细胞的重新聚集、活化和肺损伤的增加。此外,它有利于腺泡细胞坏死而不是凋亡,而凋亡本身与促进炎症反应有关。多种趋化因子如IL-8在AP中也升高。IL-8是中性粒细胞的强诱导剂,研究表明,AP和ARDS患者支气管肺泡灌洗液(BAL)中IL-8水平高于不发生ARDS患者。此外,BAL中IL-8和抗IL-8抗体复合物的水平与AP患者ARDS的发生有关。其他促炎细胞因子如IL-1β和IL-6也在AP患者中升高。这些细胞因子是巨噬细胞的重要激活因子,可增强B细胞和T细胞的活化,增强炎症反应。巨噬细胞迁移抑制因子(MIF)主要来源于T淋巴细胞,抑制巨噬细胞的随机迁移。它也是一种有效的促炎细胞因子。在动物模型中发现其在肺内水平升高,抗MIF抗体可显著提高存活率。与这些细胞因子相反,IL-10是一种抗炎细胞因子,它可以阻止巨噬细胞和T细胞产生TNF-α、IL-6和IL-1β等促炎介质。研究表明,低水平的IL-10和给药抑制IL-10可以降低AP实验动物模型中AP的严重程度。各种粘附分子如E-或P-选择素、细胞内粘附分子(ICAM-1)和血小板内皮粘附分子-1(PECAM-1)水平上调,增加了包括ARDS在内的各种器官衰竭的风险。神经肽P物质是参与AP发病的炎症介质,神经激肽受体-1(NK-1R)是P物质生物作用的受体,发现阻断NK-1R可以降低诱发胰腺炎和相关肺损伤的风险。

鉴别诊断
如前所述,AP的呼吸衰竭也可由除外ARDS的原因引起。无影像学异常的低氧血症、肺基底不张、肺水肿、胸腔积液、胰-胸膜瘘或肺栓塞是AP呼吸衰竭的重要原因。仔细的询问病史、临床检查和影像学检查对诊断是必要的。由于这些疾病的治疗与ARDS完全不同,而且许多情况都有有效的治疗方法,因此在诊断ARDS之前,应仔细排除这些疾病。
-
预测AP并发ARDS
在高危病人中,ARDS的预测仍然是最重要的挑战之一。已经出现了各种评分系统来预测危重病人的ARDS发展。肺损伤预测评分(LIPS)是预测高危ARD最常用的评分之一。Gajic等人对5584例心房颤动患者进行前瞻性随访,以评价ARDS的发生率及危险因素。6.8%的高危患者平均2天后出现ARDS。作者制定了由易感状态、酗酒、肥胖、低蛋白血症、Fio2、呼吸频率、糖尿病和酸中毒组成的评分系统。评分≥4分时,阴性预测值高达97%,阳性预测值有限为18%。评分≥4分的敏感性、特异性和曲线下面积(AUC)分别为69%、78%和0.8%。然而,在这项研究中,只有5.8%的患者合并AP。由于未提供AP的严重程度,且在该研究中只有3%的AP患者出现ARDS。同样的评分系统也得到了后续研究的验证,并显示出相似的敏感性、特异性和AUC。然而,上述LIPS评分系统的阳性预测价值有限,因此,后续的研究制定了新的评估急性生理学和慢性健康评估II(APACHE II)评分系统、IL-6、IL-8、血管生成素2等其他标记物对危重病患者ARDS的预测作用。然而,许多研究都是单中心研究,样本量小,因此,这些研究并没有成为治疗的标准。在这些标记物中,当血管生成素2被添加到评分系统时,显示出了很有价值的结果。研究表明,在评分中加入血管生成素2可使阳性预测值(PPV)从18%、45%增加到60%,且具有相似的阴性预测值(NPV)、敏感性和特异性。同样,Levitt等人前瞻性纳入100例双侧胸片异常(非左心房高压所致)患者,并随访其发展为ARDS的结果。研究发现,初始耗氧量>2l/min、胸片异常、免疫抑制剂的使用和SIRS的存在是ARDS发生的预测因素。近年来,肺超声通过估计血管外肺容积(EVLW)在预测危重患者ARDS和治疗反应中也显示出了一定作用。

(未完待续)

相关阅读
- 11-10 【党支部靓晒】综合3支部:重症医心 温暖有我
- 11-11 准妈妈ICU昏迷一个月,医生:一直隐藏的秘密终于泄露了......
- 10-29 COVID-19流行期间重症监护中的床旁肺部超声
- 10-29 肝硬化患者的自发性细菌性腹膜炎和腹膜外感染(上)
- 10-20 妊高症回顾(上)
- 10-20 妊娠期高血压疾病与心血管疾病相关发病率和死亡率的系统评价分析
- 10-07 经鼻雾化吸入(上)
- 10-07 经鼻雾化吸入(下)
- 10-07 重症患者AKI的生物标志物
- 10-07 重症患者发生AKI增加死亡率?
