【重症风采】连载20 | ECMO支持下的抗凝监测:活化凝血时间和抗Xa活性监测的对照研究

ECMO支持下的抗凝监测:活化凝血时间和抗Xa活性监测的对照研究
李沂玮 译
1953年Gibbon医生通过体外循环(ECC)用于暂时性的心肺替代,从而顺利完成心脏手术。得益于ECMO技术,ECC为各种原因所致的急性呼吸窘迫综合征(ARDS)、心源性休克和难治性心跳呼吸骤停提供数天至数周的呼吸替代与循环支持。由于ECMO辅助患者的出血和栓塞等凝血相关并发症的风险上升,还需要监测凝血功能,并及时调整抗凝药物剂量。活化凝血时间(ACT)是一项简便、快速的床旁监测指标,常规用于监测ECC患者,是目前最广泛使用的监测工具,但个体差异影响大,尤其是在长期生命支持和情况不稳定的患者(如低温、血管充盈、血小板功能障碍等)。由于ACT的不稳定性,目前凝血监测的替代方法还包括:抗Xa活性、抗凝血酶III活性(AT)或血栓弹力图。抗Xa活性常用于肝素抗凝活性的测定,目标范围为0.3~0.7IU/mL,对ECMO辅助患者的稳定性和准确性更高。本实验对109例ECMO患者进行了针对普通肝素抗凝强度监测ACT和抗Xa活性水平的比较。
材料和方法
回顾性分析2014年1月至2015年12月在法国Toulouse Rangueil医院ICU住院并应用VV-ECMO或VA-ECMO辅助的109例成年患者,包括ARDS、胸外手术后、难治性心源性休克及难治性心跳骤停。该研究已获得图卢兹大学医院伦理委员会批准。
所有患者在ECMO启动后持续静脉注射50IU/kg普通肝素(UFH)抗凝,根据ACT(180~220s)给予进一步的UFH剂量调整。为了研究抗Xa活性和ACT与肝素抗凝剂量的关系,研究者在ECMO启动后5天内同时进行一天两次的抗Xa活性和ACT监测。根据法国指南采用柠檬酸盐真空管进行血液采样,并在30分钟内送至实验室进行血浆去血小板化,再于2小时内进行检测抗Xa活性。
观察指标:患者一般情况(性别、年龄),疾病严重程度(简明急性生理状态量表(SAPS)、ECMO类型(VV或VA)及持续时间,病情转归),ECMO支持期间每日的临床指标(动脉血PH、肌酐、血碳酸氢盐、凝血酶原时间(PT)、活化部分凝血酶原时间(APTT)、血小板计数)以及是否有影响止血的事件发生(抗血栓治疗、输血、连续性肾脏替代疗法)。
统计学方法
采用MedCalc 15统计软件进行数据处理。描述性统计包括使用Kolmogorov-Smirnov检验数值分布,以及对峰度和非对称性(偏度)系数的分析。计量资料以中位数和四分位数表示,计数资料以百分比表示。考虑到数据呈非正态分布性,采用Mann-Whitney非参数检验对VA-ECMO和VV-ECMO组患者的ACT和抗Xa活性值进行检验,采用Spearman等级相关性检验分析ACT和抗Xa活性值的关系。
根据文献报道,ACT的目标值设为180~220s;根据出血发生率,抗Xa活性目标范围降为0.2~0.4IU/ml,并将ACT和抗Xa活性值转换为分类变量(达到目标值的1/4和未达到目标值的1/4)。对上述结果进行Kappa检验,计算Kappa值,检验两种测量方法对各自目标值的一致性。依据Landis和Koch的6级术语进行分级:(1)不一致:0.00;(2)一致性差:0.00~0.20;(3)一般的一致性:0.21~0.40;(4)中等的一致性:0.41~0.60;(5)高度的一致性:0.61~0.80;(6)几乎完全一致:0.81~1.00。为了证实实验结果,研究者进行了ACT和抗Xa活性之间的相关性分析(Spearmanρ),并分别检验ACT和抗Xa活性目标值的一致性(κ)。P<0.05为差异有统计学意义。
结果
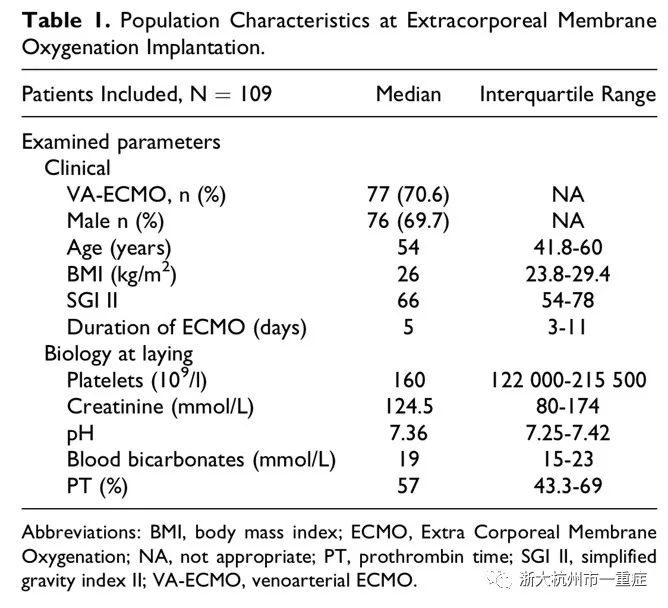
109例患者的基本资料见表1。其中行VA-ECMO治疗的77例(70.6%)患者中:32例心跳骤停、40例心源性休克(原发疾病:冠状动脉疾病、扩张型心肌病、心肌炎和心包填塞),5例药物中毒; 行VV-ECMO的32例(39.2%)患者中:28例ARDS、2例肺移植术后、2例难治性哮喘。ECMO支持的持续时间中位数为5(范围4-7)天,极值从几小时至30天不等。
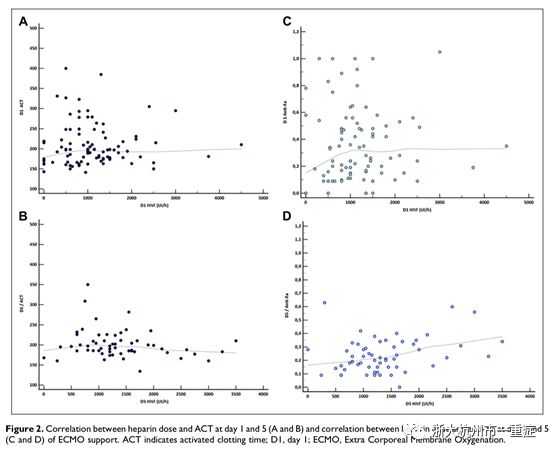
在ECMO启动5天内达到ACT目标范围(180~220s)所需普通肝素的中位剂量为800~1200IU/h(表2)。图1显示当达到ACT传统目标范围(180~220s)时,抗Xa活性值低于其目标值。此外,研究者发现ACT的差异性随着ECMO持续时间的延长而增大。如图2和表2所示,肝素剂量与抗Xa活性结果的相关性较低,而肝素剂量与ACT无相关性。
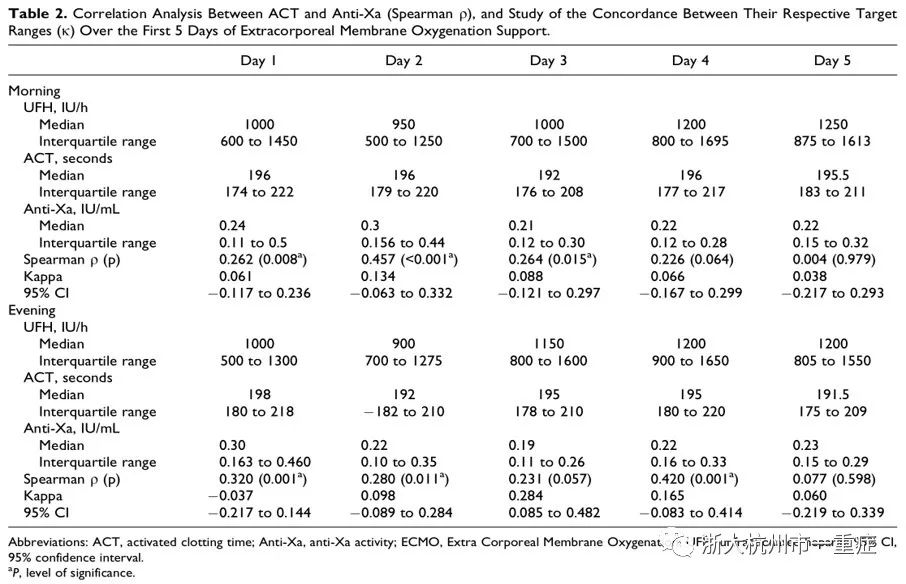
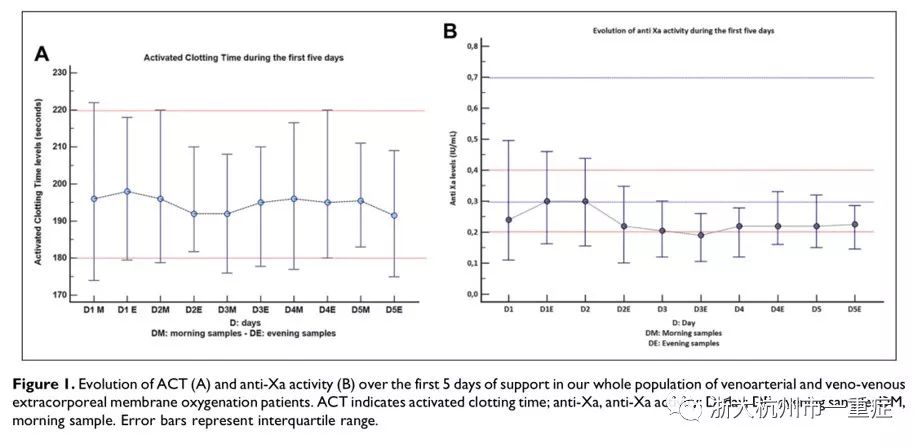
表2显示,ECMO支持下的两种监测方法(ACT与抗Xa活性)无相关性(ρ<0.4),且与进行检测的时间无关。并且,随着ECMO持续时间的延长,Spearman系数逐渐下降,表明ECMO持续时间越长,两者不相关性越明显,若将抗Xa活性目标范围设为0.3~0.7IU/ml,两者亦无相关性(表3)。此外,我们使用κ系数作为补充方法来检验这两种测量方法对目标范围的一致性,结果显示ACT的目标范围与抗Xa活性的目标范围有轻微一致性(κ<0.2,表2)。
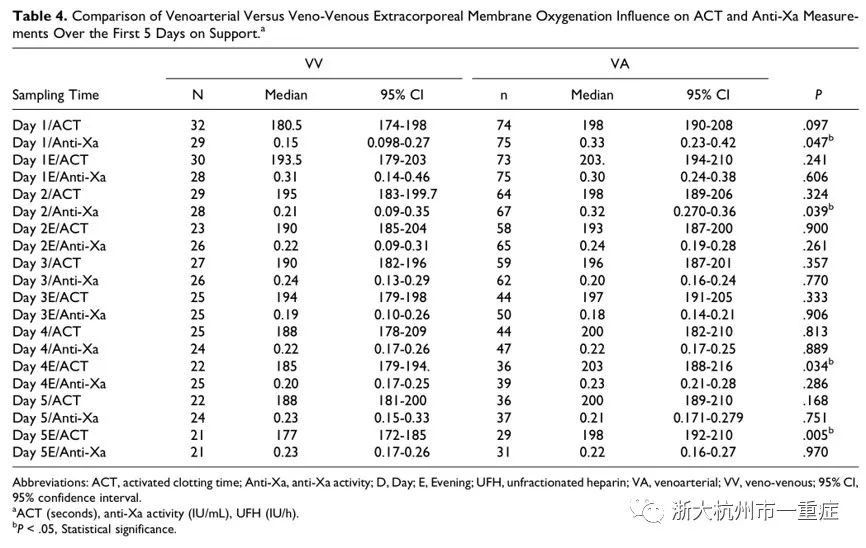
值得一提的是,VA-ECMO组患者与VV-ECMO组患者具有明显差异:在ECMO启动后前5天,VA-ECMO组ACT中位值较VV-ECMO组高;而只有在ECMO启动后第1天和第2天,VA-ECMO组的抗Xa活性中位值较VV-EVMO组高。在ECMO启动后第5天,尽管抗Xa活性中位值在两组患者中相似,但ACT目标值仅在VA-ECMO组中实现(图4)。
讨论
研究结果认为,ECMO支持下的凝血监测—ACT与抗Xa活性相关性低,且仅具有轻微一致性。相比ACT,抗Xa活性与普通肝素剂量相关性更高,所以该研究推荐使用抗Xa活性对手术期普通肝素使用患者进行监测。
入住ICU患者的凝血评估非常复杂,而体外循环下的抗凝治疗则更具挑战性。临床上,平衡体外循环凝血和抗凝后出血的风险,需要更精细化的预估和管理。尽管如何对ECMO治疗的患者进行凝血监测尚未达成共识,且缺乏大规模临床随机对照研究,但UFH仍是推荐的抗凝方案。
ECMO期间,尤其是VA-ECMO患者,约有40%~60%患者会发生出血,并与死亡率密切相关。因此精细的抗凝管理可减少出血发生率,改善ECMO患者预后。
近日,一项来自ELSO中心的全球性调查发现,ECMO患者的抗凝监测方法仍存在争议,目前ACT是使用最广泛的肝素监测指标,但ACT重复性差,且影响因素多,如缺乏凝血因子、血小板减少症、血小板功能障碍、低纤维蛋白血症、低体温和血液稀释等,且ACT可能会高估肝素的抗凝强度,使得患者抗凝不足。此外,ECMO并发高炎症反应影响AT和血小板的生成,减弱ACT和纤维蛋白形成的相关性。以上均提示ACT可靠性和敏感性差,因此ACT进行肝素监测具有一定局限性。
基于以上原因,许多中心通过监测抗Xa活性或联合其它指标评价肝素抗凝强度,其原理是血浆中的肝素与AT结合形成肝素-AT复合物后,再与Xa进一步结合,而未结合的Xa可与发光底物结合而显色,抗Xa活性可直接代表肝素的抗凝活性。通过监测抗Xa活性对肝素剂量进行调整有利于降低血栓和出血致死风险,但其最佳目标范围仍无定论。在制定目标范围前,应考虑各种可能影响凝血功能的情况,如使用抗血栓或抗血小板药物,心脏手术肝素化或术后凝血病,心源性休克并发肝、肾功能衰竭,术中难以逆转的出血等。ELSO推荐0.3~0.7IU/mL作为抗Xa活性的目标范围,但此数据尚未通过大量随机对照试验得到证实。根据笔者中心的ECMO患者发生出血概率的数据分析,将抗Xa活性的目标范围重设为0.2~0.4IU/mL,与传统的ACT测定肝素抗凝活性进行对比。
迄今为止,较少有研究对ECMO患者进行ACT和抗Xa活性评价肝素抗凝强度的比较。本研究数据表明通过抗Xa活性监测肝素抗凝强度优于ACT或APTT。但抗Xa活性值和ACT值并不相关,导致在肝素的持续时间及剂量调整等实施过程中存在矛盾性和不确定性。此外,在VV-ECMO和VA-ECMO患者中,抗Xa活性和ACT监测肝素抗凝活性也存在显著差异,进一步说明两者之间缺乏一致性,尤其在ECMO开始后第4天和第5天,即使调整肝素剂量也不能缩小两者的差异。差异的引起可能是由于:①血小板功能的抗凝治疗(阿司匹林和抗P2Y12);②VA-ECMO并发症(出血、血栓等);③VA-ECMO对机体血流动力学的影响可能导致凝血时间延长,抗Xa活性降低。
结论
研究表明ECMO期间抗Xa活性和ACT对肝素抗凝强度的评价无相关性。由于抗Xa活性监测肝素抗凝强度优于ACT,所以推荐使用抗Xa活性进行肝素抗凝监测。但抗Xa与出血/血栓发生的关系尚不明确,仍需大量标准化前瞻性研究数据确立安全的抗Xa目标范围。

相关阅读
- 11-10 【党支部靓晒】综合3支部:重症医心 温暖有我
- 11-11 准妈妈ICU昏迷一个月,医生:一直隐藏的秘密终于泄露了......
- 10-29 COVID-19流行期间重症监护中的床旁肺部超声
- 10-29 肝硬化患者的自发性细菌性腹膜炎和腹膜外感染(上)
- 10-20 妊高症回顾(上)
- 10-20 妊娠期高血压疾病与心血管疾病相关发病率和死亡率的系统评价分析
- 10-07 经鼻雾化吸入(上)
- 10-07 经鼻雾化吸入(下)
- 10-07 重症患者AKI的生物标志物
- 10-07 重症患者发生AKI增加死亡率?

