多发性骨髓瘤基于分子生物学检测的个体化治疗


摘要
近几十年分子检测技术的快速发展,使得大家对多发性骨髓瘤的发病机制有了更深刻的理解(见图1)。

最初的研究使用的是G带测定细胞遗传学异常,如免疫球蛋白重链(IgH)基因易位和超二倍体作为启动事件。t(4;14)、t(6;14)、t(11;14)、t(14;16)、t(14;20)等易位使得原癌基因MMSET/FGFR3、CCND3、CCND1、MAF和MAFB处在IgH基因增强子的调控下。上述原癌基因表达增加,使得cyclinD蛋白家族表达上调,最终导致G1/S检查点失调。超二倍体也影响这一检查点,尽管其获取和下游效应失调的机制尚不明确,有研究表明,继发获得性损害也参与细胞周期的异常调节,从而导致细胞增殖和疾病进展。
随后使用的FISH、GEP、SNP技术拓宽了我们对多发性骨髓瘤生物学的认知,并且根据这些技术检测到的结果进一步进行危险分层。
最近几年,二代测序(NGS)技术能够识别单核苷酸突变(SNV),同时也能识别大的结构改变,包括易位、拷贝数改变。NGS较以前的技术更为快速和实惠,可识别出多种多发性骨髓瘤驱动基因,最常见的细胞遗传学异常见于RAS和NF-κB家族,许多突变与原发性骨髓瘤分子亚型相关,表明潜在的启动事件导致了随后的分子畸变。目前,部分新技术已通过CLIA认证,可用于诊断,而部分技术(例如DNA甲基化分析)仍局限于实验室研究。
预后标志物的进展
预后标志物通常用于预测疾病复发的可能性及总生存期。不管采用何种治疗方案,预后标志物都能预测结局,并提供更具个性化的治疗建议。目前已经确定数个细胞遗传学异常导致骨髓瘤的不良结局,其中一部分是克隆起始损伤如t(4;14) 、t(14;16)、t(14;20),另一部分是染色体结构改变或突变事件,倾向于发生在疾病演变的后期阶段。
1.t(4;14)——10%-15%发生率
t(4;14)导致组蛋白甲基转移酶、MMSET和FGFR3基因移位到IgH基因增强子的下游。MMSET表达增加和FDFR3表达缺失与疾病的不良结局相关。MMSET导致表观遗传性重组,产生大量下游效应,如黏附、生长、生存的改变。同时也导致遗传不稳定,包括gain(1q)、del(12p)、del(13q)、del(22q)、BIRC2/3纯合缺失,均与不良结局相关。与其他危险分层组相比,t(4;14)的结果具有异质性,可能是受其他细胞遗传学异常和或del(17p)所影响。
2.t(14;16)/t(14;20)——2%-4%发生率
t(14;16)和t(14;20)分别导致MAF和MAFB上调,同时也和gain(1q)和del(17p)相关。这些亚组还与突变标志(突变类型的特征)相关,而突变标志与mRNA编辑酶APOBEC的活性相关。研究表明MAF和MAFb蛋白介导蛋白酶体抑制剂耐药,可能是大多数研究中t(14;16)和t(14;20)为不良结局的原因。
3.Del(17p)——8%-10%发生率
17号染色体短臂的缺失与不良结局有关,与抑癌基因TP53表达缺失有关。尽管偶尔有研究表明,FISH检测到<20%细胞的TP53缺失有临床意义,但大多数研究认为>20%才会有显著临床影响。随着克隆大小的增加,对结果的影响变得更加显著,一些研究表明,至少需要60%的细胞TP53缺失才对结局产生显著应县。最近的数据表明,双等位基因破坏(不管是两个染色体缺失,一个染色体缺失和等位基因的TP53突变,还是双等位基因突变)会导致不良结局。
4.Gain(1q)——30%-35%发生率
尽管已知gain(1q)与不良预后有关,但无法具体到哪个基因与不良预后相关。最常获得的(1q21)基因位点包括BCL9,MCL1,CKS1B和ANP32E基因。该基因位点易于因着丝粒周围染色质的不稳定性而发生突变。位于1q32基因位点的CD45等重要基因因大范围的染色体易位而发生突变。获得(定义为增加一次拷贝)和扩增(定义为增加>1次1q拷贝)存在区别,其中扩增的病例与不良结局相关。
5.其他易位或拷贝数异常
Del(1p)常和gain(1q)共同存在,有10%的发生率,与自体干细胞移植患者的不良预后相关,可能是与位于1p32基因位点的CDKN2C和FAF1和(或)位于1p12基因位点的FAM46C和(或)位于1p22基因位点的RPL5和EVI5缺失相关。
Myc异常常见,有15%-20%的发生率,与疾病不良预后相关,可能是因为8q22位点的MYC发生继发易位或拷贝数改变。
t(11;14)和超二倍体通常被纳入标危组。一些研究表明,三体能够克服t(4;;14)和del(17p)的不利影响,其中三体3的影响最大。但也有研究不支持这一观点。
6.突变
与不良结局相关的突变,包括CCND1和DNA修复途径基因(TP53,ATM,ATR和ZFHX4),可作为预后标志物。而IRF4和EGR1可作为疾病预后良好的预后标志物。随着与不良预后相关的全基因组杂合性缺失的增加,基因组不稳定性的突变分析还可以预测不良预后。
7.RNA改变
尽管基于DNA的检测能够识别单个基因损伤和全基因组不稳定性的标记物,但是RNA和基因表达谱(GEP)可以用于检测增殖增强和特定途径表达变化的标记物。与上述讨论的任何单个基因损害相比,70基因的GEP评分GEP70(MyPRS)或92基因的SKY92具有更好的预后预测能力。他们发现约15%的初诊患者可依据该方法纳入高危组,而局限性在于缺乏广泛的可用性和结果解读的能力。
另外研究者使用RNA-seq数据在多发性骨髓瘤中发现了新的融合基因,其中部分与不良预后相关,例如CSNK1G2、CCND1和PFS缩短相关,MMSET、BCL2L11和OS缩短相关。
8.其他疾病特征
疾病的其他特征可能也与患者的高危结局相关,可以作为预后标志物。诊断时原始浆细胞的细胞形态、肾功能衰竭、髓外疾病和浆细胞白血病的存在均与不良预后相关。外周循环浆细胞的存在,即使水平低于浆细胞白血病诊断标准,也与不良预后相关。最近有研究表明,PET-CT和MRI成像上局灶性病变的数量和大小也提示不良预后,与分子特征无关。
9.危险分层:结合生物标志物
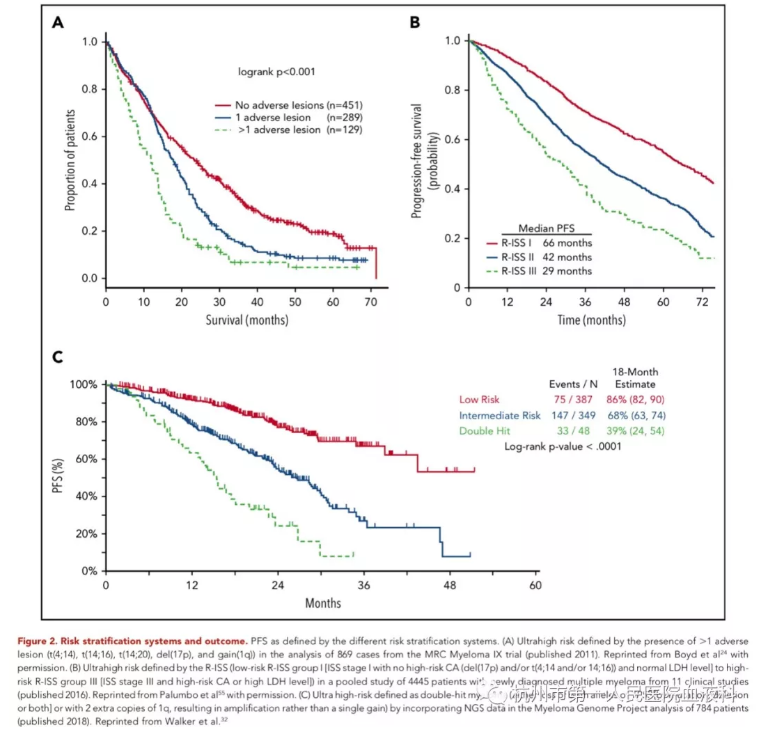
随着技术的进步和数据增加,分子损伤对临床的影响也发生改变。从使用单个损害定义高危疾病变为使用2-3个损害同时定义。此外,由于 “高风险”病变可能发生在30-50%的患者中,无论治疗方法如何,预后仍差,因此越来越需要确定一小组(<15%)的患者,将其视为“超高危”患者,并通过以下方式对其进行鉴别(见图2)。
>1个不良遗传学损害
如上所述,与不良结局相关的易位和拷贝数变化已被证明具有累积性,比如>1个遗传学损害的存在较单独一个遗传学损害的预后更差。在MRC Myeloma IX研究中,具有多个不良遗传学损害的患者为超高危,占15%。(见图2A)
R-ISS
修订的国际分期系统(R-ISS)评分在β2M、白蛋白和LDH的基础上结合基因的结构损害,为更准确地预测风险。分为R-ISS I、II、III三组,低危R-ISS I组、ISS I组,无高危细胞遗传学异常,如del[17p]和或t(4;14和或14;16),LDH正常范围;高危R-ISS II组、ISS III组,同时存在高危细胞遗传学异常或LDH升高。10-18% 的患者为R-ISS III。(见图2B)
双打击多发性骨髓瘤
骨髓瘤基因组计划结合了NGS和基因结构异常,将“双打击”骨髓瘤定义为超高危者,即同一基因两次打击,如TP53双等位基因缺失(突变、缺失或二者均有)或1q的2个额外拷贝(见图2C)。这组患者占6-10%,其预后预测能力比R-ISS强。许多其他小组也确认了拷贝数和TP53突变状态的重要性,同时伴有amp(1q)代表了骨髓瘤风险预测中的最新进展。
有趣的是,部分患者未携带上述分子损伤,但仍早复发。这些患者在表型上认定为高危患者,PFS和OS也较差。因此,这类患者在初次复发时可能需要不同于标准治疗方案。识别早期复发患者的驱动因素,从而通过改变前期治疗方案,可能对长期生存具有益处。
10.不同疾病阶段的预后标志物
上面描述的生物标志物常在新诊断的患者中使用,另外,许多不良预后生物标志物在疾病的晚期变得更加频繁,但仍具有预后意义。也可以使用骨髓微小残留病(MRD)或影像学改变评价治疗反应。
高危组的治疗方法
除了提供重要的预后信息外,识别具有早期进展或死亡高风险的患者的真正好处是提早干预并提供治疗方法从而形成标准治疗方案。目前相关临床研究正在研究这种治疗方法。但这些研究面临的挑战是,高危组和标准组患者之间的缓解率无差异,不同点在于高危组会早期复发。在定义为del(17p)或≥2个细胞遗传学异常的患者中,严格的完全缓解(sCR)和MRD阴性并不能转变为更好的PFS或OS。
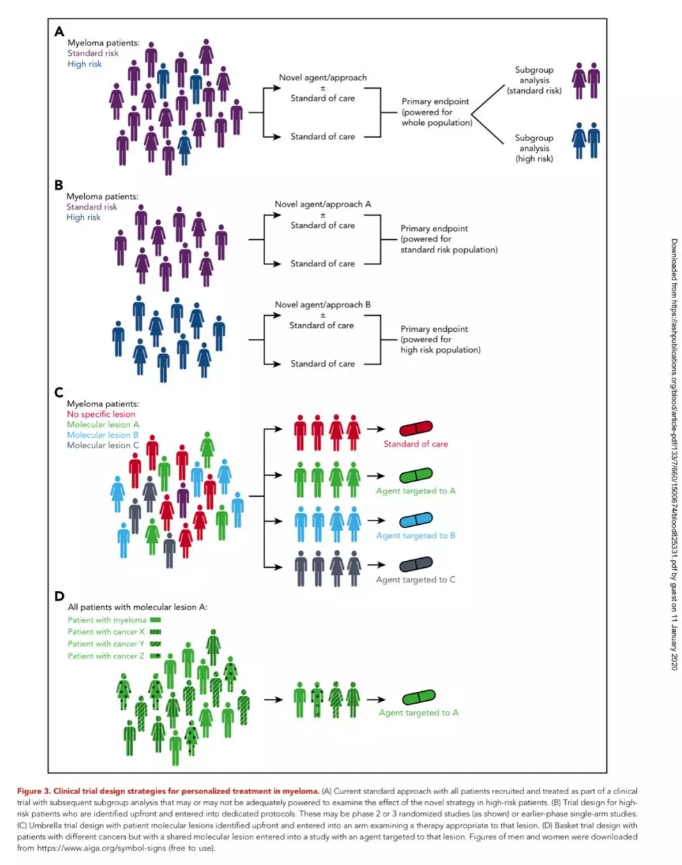
可以通过两种方式进行针对高危患者的试验, 在所有临床试验中,可以分别分析和报告高危亚组,并与非高危患者进行比较,或者可以专门设计试验以优化预期招募的高危组的治疗(图3A-B)。第一种方法可确保亚组分析的确定性,即给定的治疗方法在高危人群中的获益与标危人群相同,但对较小的高危人群的疗效将受限。后一种方法可确保正确地开展研究以评估高危患者的影响,但是高危的定义必须统一并利用可重复测定的生物标记物。
既往研究发现高危患者有多种治疗方法,如蛋白酶体抑制剂克服了与t(4; 14)/ del(17p)的不良影响。随后的研究和荟萃分析证实,与基于非硼替佐米的诱导方案相比,基于硼替佐米诱导治疗可改善预后,但不能完全克服细胞遗传学异常造成的不良预后影响。在新型蛋白酶体抑制剂carfilzomib和ixazomib治疗复发患者中的研究,高危患者的预后优于对照组,但与标危患者相比预后仍不佳。新诊断患者双次移植、移植后巩固和维持治疗均对高危患者有效,可在某种程度上改善不良结局,但迄今为止尚无策略可完全克服高危因素的不良影响,仍需开展前瞻性研究确定其治疗方案。
目前有许多纳入高危患者的临床试验正在进行中。TT5 II期临床试验招募了GEP70定义的高危患者,并进行了剂量密度化疗,减少治疗间隔,以防止在治疗间隔期间发生复发,如自体移植后发生复发。将研究中的患者与风险匹配的TT3研究中的患者进行比较,生存预后无差异,但早期治疗中的复发减少,而倾向于在后期维持阶段复发。TT5b和TT7研究合并了较新的蛋白酶体抑制剂和免疫治疗,其他研究在探索如何增强诱导强化,自体、异基因移植以及诸如CAR-T细胞的免疫治疗,如UK MUK9b试验(NCT03188172),US 2015-12试验(NCT03004287)和德国GMMG-CONCEPT试验(NCT03104842)为例,采用CD38抗体,蛋白酶体抑制剂和来那度胺作为强化治疗,并延长巩固和维持治疗。
这些研究之间的主要区别是高风险的定义(如GEP70),这将使随后对PFS和OS进行直接比较具有挑战性。高危多发性骨髓瘤患者的治疗是尚未满足临床需求的领域,使得新药或新方法用于临床存在可能,如CAR-NK细胞,双特异性抗体治疗和抗体药物偶联剂即将进入治疗高危多发性骨髓瘤的一线研究。另外还有研究通过测定诱导治疗后MRD指导后期治疗,MRD阳性患者采取强化治疗,MRD阴性患者采取降级治疗。
预测标志物的进展
预测标志物用于预测特定药物可产生有利或不利结局的影响。2/3患者存在可以预测的突变,其他靶突变包括易位和/或蛋白质表达模式改变。下面提到数个针对靶突变的临床研究。
目前临床试验中利用生物预测标志物的靶向治疗
Venetoclax
Venetoclax是抗凋亡蛋白BCL2抑制剂。体外研究显示, t(11;14)细胞株和患者标本对venetoclax有较高敏感性,可能与BCL2与MCL1的高表达相关。复发/难治性多发性骨髓瘤患者的单药Venetoclax研究表明,t(11; 14)患者总体反应率(ORR)为40%,同时BCL2:MCL1和BCL2:BCL2L1 mRNA表达水平与疗效和t(11; 14)状态相关。venetoclax与硼替佐米和地塞米松的治疗组合的研究表明,所有患者的ORR为67%,t(11; 14)患者为78%。与单药研究相似,BCL2表达较高的患者反应更好,PFS更长。无t(11;14)或高BCL2表达患者的高疗效可能源于硼替佐米上调NOXA(一种促凋亡因子),NOXA可以中和MCL1作用,提高BCL2∶MCL1比例和对venetoclax的敏感性。这些发现表明,BCL2∶MCL1或BCL 2∶BCL2L1 mRNA表达可以作为预测标志物,用于指导治疗。
RAS途径抑制物
测序研究表明在大约50%的患者(25%NRAS,25%KRAS和4%BRAF)存在RAS突变,从而评估RAS途径抑制剂的治疗作用,如BRAF抑制剂(vemurafenib和dabrafenib)和MEK抑制剂(trametinib和cobimetinib)。虽然目前关于RAS途径抑制剂的病例报告和病例系列居多,但结果仍显示其对复发/难治性患者发挥治疗效果,为提供更全面的疗效分析,一系列前瞻性研究正在开展。
靶向药物的发展
目前已经确定了可预测治疗反应的一些靶点,如IDH1/IDH2突变和IDH抑制剂、杂合性缺失或ATM/ATR突变和PARP抑制剂、FGFR3突变和FGFR3抑制剂。
实体瘤的最新研究表明,高突变负荷的患者对PD-1/PD-L1抑制剂反应非常好。通常多发性骨髓瘤的突变负荷低于实体瘤,但t(14;16)MAF易位患者具有APOBEC特征和高突变负荷,为免疫检查点抑制剂的治疗提供了依据。
靶向治疗的局限性
靶向药物使用的不足之处在于患者必须存在克隆异质性的存在,但并非所有细胞都存在细胞遗传学异常,同时同一患者、不同时间点、不同部位的活检也会存在分子差异。另一个局限性是缺乏整合RNA和蛋白质水平数据的能力。由于药物主要作用于蛋白质,因此蛋白质水平突变的影响很重要,随着更多整合分子模型的出现,这一局限可以克服。第三点局限性在于多发性骨髓瘤的突变频率低,不利于开展临床研究,伞式研究或篮子研究可能适合解决这一问题。
结论
在过去的十年中,低危多发性骨髓瘤患者的生存得到明显改善,PFS超过8年。目前多发性骨髓瘤个体化治疗主要考虑年龄和并发症,而很少考虑分子信息,若要进一步改善治疗结局则需要纳入分子信息来指导治疗,改善预后。本文描述了两种方法,第一种方法是针对存在高危标记物的多发性骨髓瘤患者,使用与分子损伤无关的强化治疗方法。第二种方法是采用分子靶向药物单药或与其他药物(如蛋白酶体抑制剂,免疫调节药物和单克隆抗体)联合进行治疗。

相关阅读
- 09-13 第八期“浙大市一.临床大讲堂”预告
- 05-24 2021年第三届湖畔眼底病高峰论坛暨浙江省级继续医学教育项目《玻璃体视网膜疾病诊疗进展》圆满举办
- 10-29 COVID-19流行期间重症监护中的床旁肺部超声
- 10-29 肝硬化患者的自发性细菌性腹膜炎和腹膜外感染(上)
- 10-20 妊高症回顾(上)
- 10-20 妊娠期高血压疾病与心血管疾病相关发病率和死亡率的系统评价分析
- 10-07 急性心梗后超声可发现的机械性并发症
- 10-07 做了一回赵半仙--高血压心脏病
- 10-07 综合生命支持降低暴发性心肌炎死亡率的多中心研究(上)
- 10-07 经鼻雾化吸入(上)
