重症监护中抗生素相关损害的叙述性研究(下)


翻译:林华鹏 编辑:李沂玮
抗生素相关危害的可能机制
机制:耐药性
最广泛认可的抗生素相关损害机制是出现耐药性(AMR)。虽然AMR的威胁现在已得到广泛承认,但较少受到关注的是抗菌治疗在接受这些抗生素的患者中发展为随后的多重耐药(MDR)感染中的作用。
MDR病原体引起的感染与死亡率和住院时间的增加有关。他们更可能对常用的经验性抗菌药物产生耐药性,从而延误有效治疗。如β-内酰胺和糖肽类治疗金黄色葡萄球菌感染,它们还常常需要使用具有较低杀菌活性和不良药理特性/毒性的抗菌药物进行治疗。产生MDR病原体是ICU获得性感染的常见原因,据一项欧洲研究估计,三分之二以上的ICU获得性菌血症是由MDR细菌引起的。
重症监护中常见的MDR细菌与危重病人使用抗菌药物有关。例如革兰氏阳性菌,如耐甲氧西林金黄色葡萄球菌(MRSA)和耐万古霉素肠球菌(VRE),其流行率似乎相对稳定。相反,耐多药革兰阴性菌(如耐碳青霉烯类铜绿假单胞菌、鲍曼不动杆菌和耐碳青霉烯类/超广谱β-内酰胺酶(ESBL)产肠杆菌)的比率似乎在上升。
重症监护病房的病人特别容易发生多药耐药菌感染。其中一个原因是重症监护患者在ICU住院期间和之前都会接触大量的抗菌药物。病例对照研究分析了感染碳青霉烯酶耐药肠杆菌(CRE)的危险因素,发现近期使用抗菌药物和碳青霉烯类药物是最大的危险因素。同样,最近的一项荟萃分析,特别是对ICU中MDR革兰阴性菌感染的危险因素的研究,发现抗生素治疗是关键。
呼吸道感染和VAP是医院获得性感染的主要原因。一项对疑似VAP的观察队列研究和一项经微生物学证实的VAP的RCT显示,在接受较长时间抗生素治疗的患者中,随后MDR相关的二重感染显著增加。关键是,这两项研究都没有显示长期使用抗生素对降低死亡率带来好处。
已经证实,在ICU入院后的几天内,通气患者的口咽部可能会被多种耐药菌感染,这与抗生素的使用有关。人们也越来越深刻的认识到,接触抗菌药物会导致对同一类抗菌药物以及不同种类抗菌药物耐药的病原体的感染。这可能强调了由抗生素治疗引起的宿主微生物群的复杂性,以及抗生素相关的失调(见下文)如何与MDR生物体的选择相关。利用数字模型,在荷兰的两个ICU中进行的研究表明,获得MDR肠杆菌的主要途径是内源性的,而不是外源性交叉污染。
机制:微生物群的破坏
当共生菌和致病菌的不平衡发生在失调的微生物群中时,医疗获得性感染(HAI)和相关并发症在内的局部和全身疾病的风险增加。微生物群的改变和失调不仅会增加感染的风险,也有可能促进耐药性基因的增加,成为诸如ESKAPE等MDR生物的来源。ESKAPE病原体(屎肠球菌、金黄色葡萄球菌、肺炎克雷伯菌、鲍曼不动杆菌和肠杆菌属)是引起HAI的主要原因,在危重病人中可引起危及生命的感染。菌群失调的影响超出了菌群过度生长的影响,多样性的丧失会破坏宿主与其微生物之间的代谢的共生关系,从而直接导致生殖和器官功能障碍。
危重症疾病直接导致人体菌群的改变和失调。据报道,肺内微生物多样性下降,会导致潜在病原体如葡萄球菌和假单胞菌数量增加。与未经VAP通气的患者相比,VAP患者的肺功能障碍会更严重。尽管肠道微生物群存在个体差异,但脓毒症和非脓毒症危重患者的细菌多样性显著降低。延长ICU住院时间也与肠道微生物多样性低和MDR有机体的存在有关。虽然危重病的过程本身会导致肠道微生物群的破坏,但在重症监护病房中频繁使用抗菌药物会进一步对肠道微生物群的多样性产生不利影响。在重症监护病房中使用抗菌药物的频率很高,因此在人类疾病中明确这些过程的作用具有挑战性,尽管动物模型确实表明两者都起主要作用。
抗菌药物对微生物的影响
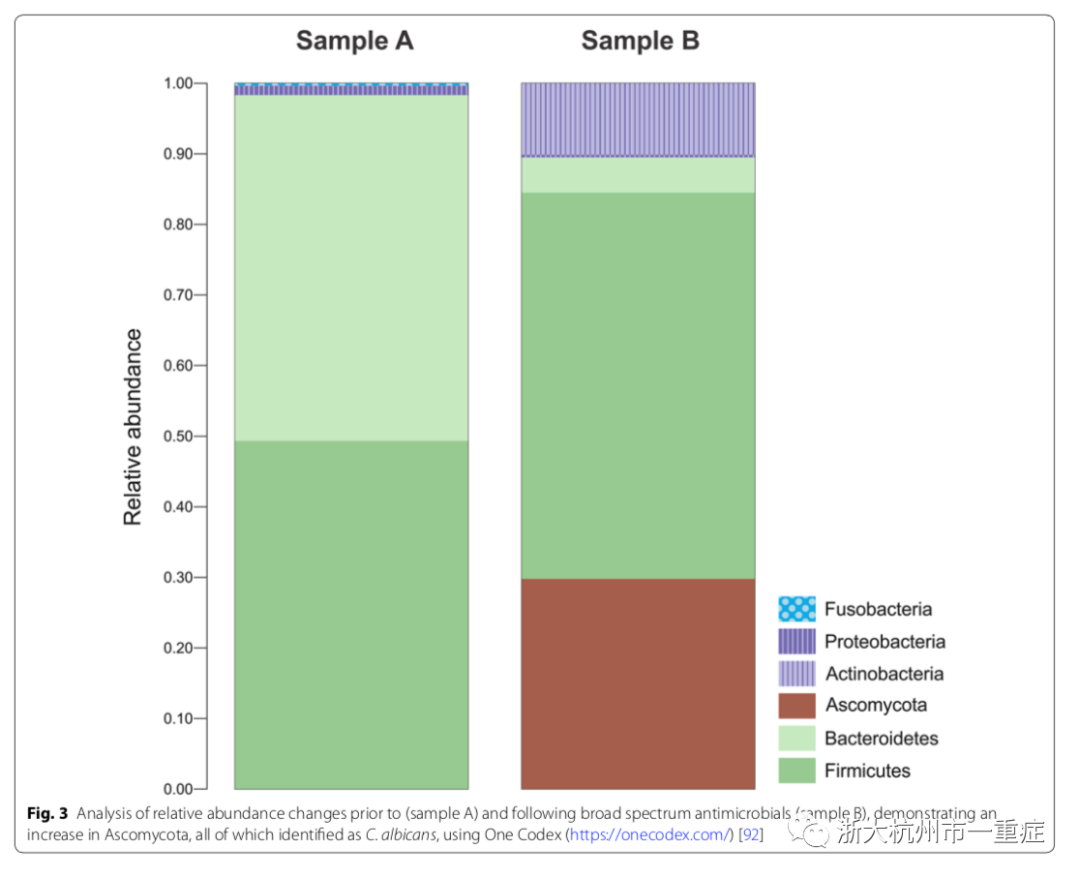
在使用广谱抗菌药物如美罗培南后,重症监护患者的肠道微生物多样性明显消失。在澳大利亚皇家布里斯班医院ICU进行的一项研究中显示,使用基因组学观察到了类似的结果。图3显示了广谱抗菌药物治疗后,患者体内分离到的白念珠菌数量显著增加。这一发现与拉维及其同事的观察结果一致。白念珠菌被认为是危重病患者的一个严重问题,并且在重症监护患者中,念珠菌易形成定植。拉维和他的同事进一步研究发现,75%的长期入住ICU患者(其中大多数接受了抗菌药物治疗)中,ESKAPE病原体(如屎肠球菌、肺炎克雷伯菌和阴沟肠杆菌)相对丰度有所增加,说明了抗菌治疗对耐药菌群的选择性作用。在这项研究中,24名患者中有23名接受了抗菌药物治疗,其中美罗培南与病原菌的增加和有益菌的减少有关,如普劳兹涅茨粪杆菌和木犀阿克曼菌。
虽然,危重病患者会发生生物合成障碍,且抗菌药物是导致这种情况的主要因素,但由于我们目前还没有有效的干预措施来协调菌群,因此这对患者结局的影响还不太清楚。然而,在动物模型中,抗生素引起的菌群失调会加重脊髓损伤,通过降低粘膜IgA水平增加假瘤性肺部感染的风险,并降低对甲型流感的免疫能力。由菌群失调引起的疾病中,最显著的是艰难梭状芽胞杆菌相关性腹泻(CDAD)。虽然已清楚抗菌药物暴露与CDAD之间的联系,但最近才意识到这并不仅仅是耐药菌的原因。在CDAD中,由于粪便微生物移植的显著反应。及其恢复肠道微生物群的能力,强调了菌群失调在CDAD中的作用。
减少危害:研究议程
鉴于抗菌药物在治疗感染中的作用,如何减轻抗生素相关副作用是目前有待解决的问题。
减少非细菌感染和非感染性条件下抗菌药物的使用,以及尽量缩短疗程且避免不必要的广谱或多药联合可以减少抗生素相关危害。后续研究应侧重于确定抗菌药物管理计划的最佳组成以及如何推动临床管理策略的改变。
通过预防性抗生素使用可以减少重症监护患者的二次感染。分子诊断技术允许对病原体更快速和敏感的检测,而宿主聚焦诊断可以识别感染菌而非定植菌。然而,这些试验对抗菌药物的影响尚未明确,应成为未来研究的重点。病原菌致敏试验敏感性的提高,可能不适当地增加抗菌素的使用。限制这种不适当的增长需要区分侵袭性感染菌和定植菌,并可能需要结合宿主进行综合判断。
利用肠道微生物群检测来监测和指导抗菌药物的选择具有临床前景;然而,尽管实验室可以直接对病原体进行检测,但临床应用仍需套索。需要进一步的研究来支持肠道微生物检测的临床验证,以提高检测的临床认可度。
最近对重症监护病人进行的荟萃分析表明,在口咽部或胃肠道注射这些生物体可以减少VAP的发生;然而,这种方法尚未被广泛接受。这一领域的进一步研究或可解释菌群失调是否会导致ICU病人的不良预后。然而,有关粪便微生物移植和益生菌治疗均与菌血症有关的报道,却给我们敲响了警钟。
即使改进了管理和诊断,感染患者仍将需要抗菌治疗。目前尚不知是否可防止线粒体损伤的免疫抑制和代谢副作用,同样,除了避免过量给药外,如何防止直接器官毒性的数据有限。应与进一步对抗菌素对免疫和实体器官组织作用的研究相结合,。这些药物的成功开发将开辟一个全新的治疗学分支。
归根结底,减轻与抗生素相关的危害可能多方面的努力,上述措施仍需进一步临床证实,并尽早转化为临床实践。
总结和结论
总之,以上证据表明,减少危重病管理中的抗菌药物使用,可能对患者个体产生直接的有利影响而降低死亡率。抗菌药物可能导致不良预后的原因多种多样,从直接药物毒性到生物合成障碍、免疫细胞功能障碍到特异性药物反应。解决这些问题需要制定多方面的策略。然而,在处理与抗菌药物相关的危害的第一步是应承认这一观点。我们需要建立一种认识,即抗菌药物管理不仅应是试图限制微生物耐药性的发展,并进行研究和质量改进,了解和减轻这些重要药物的严重不良反应同样重要。

相关阅读
- 09-13 第八期“浙大市一.临床大讲堂”预告
- 05-24 2021年第三届湖畔眼底病高峰论坛暨浙江省级继续医学教育项目《玻璃体视网膜疾病诊疗进展》圆满举办
- 10-29 COVID-19流行期间重症监护中的床旁肺部超声
- 10-29 肝硬化患者的自发性细菌性腹膜炎和腹膜外感染(上)
- 10-20 妊高症回顾(上)
- 10-20 妊娠期高血压疾病与心血管疾病相关发病率和死亡率的系统评价分析
- 10-07 急性心梗后超声可发现的机械性并发症
- 10-07 做了一回赵半仙--高血压心脏病
- 10-07 综合生命支持降低暴发性心肌炎死亡率的多中心研究(上)
- 10-07 经鼻雾化吸入(上)
