脓毒症的营养支持:少的时候可能已经多了


翻译:蔡学英 编辑:顾乔
摘要:
尽管有充分的理由怀疑积极和早期给予营养支持可在脓毒症期间保证治疗收益,但有关营养支持的建议却有些不足。当前指南(ESPEN和ASPEN)认为尚缺乏明确的证据证明脓毒症期间营养支持的有益作用,从而提出了一个问题:考虑到营养支持的低疗效,为什么没有高质量的临床试验证实脓毒症允许性摄入不足的有效性?在这里,我们回顾临床相关允许性摄入不足的有益效果,激发调查研究延迟营养支持在脓毒症期间的临床益处的迫切需要
关键字:营养支持,允许性摄入不足,自噬,脓毒症
引言
尽管有充分的基础怀疑积极和早期的营养支持可能在脓毒症期间具有治疗益处,但营养支持的建议却有些不足。拯救脓毒症运动建议反对早期肠外营养,基于低至中等质量的研究,但鼓励早期开始进行肠内营养。最新的ESPEN指南没有尝试对肠内营养(EN)与允许性摄入不足的有效性进行Meta分析,“由于缺乏相关研究”,根据专家共识,建议在没有休克的脓毒症患者中早期积极肠内营养支持。同样,根据专家共识,ASPEN指南还建议在血液动力学稳定患者脓毒症诊断后24-48小时内启动EN。总之,根据专家共识的一般建议,早期肠内营养支持可能是有益的。
鉴于“缺乏研究”,为什么没有高质量的临床试验证实脓毒症允许性摄入不足的有效性?事实上,至少一些大型临床试验中,启动早期肠外营养甚至被发现会产生有害影响,最近也有人指出,充分的早期营养支持可能通过抑制自噬在临床环境中发挥有害作用。一个原因可能是,虽然营养支持的潜在好处可能是显而易见的,但不太清楚允许性摄入不足是否会带来任何临床益处。在这里,我们回顾了在危重病环境中允许喂养不足的理由,所涉及的生理机制,以及可能产生的潜在治疗益处。
免疫系统的激活拮抗GI功能
胃肠道(GI)并发症在危重病人中很常见。然而,这种“功能障碍”的GI-tract也可以看作是疾病相关厌食症(SAA)的延伸——一个进化保守的疾病相关行为的方面。支持这一观点,必须注意的是,GI功能的减少不是被动的发生,而是在炎症介质的指导下表现出的详细反应。确实,炎性介质在抑制胃动力方面具有公认的作用。早期研究表明,皮下注射LPS可以抑制圆形平滑肌的自发收缩和苯甲酚刺激的收缩。同样,LPS诱导的延髓-迷走神经复合体中TNF的分泌也有助于胃淤滞。实际上,研究表明,各种促炎细胞因子,例如TNF,II-1β和IFN-γ,直接减弱了平滑肌的收缩,从而损害了胃动力。
也有证据表明炎性介质可能会改变胰腺的外分泌功能。在脓毒症患者中,外分泌功能障碍似乎反映出疾病的严重程度,暗示炎症会抑制外分泌功能。然而,尚不清楚炎症介质如何促进这些变化,即它们是否通过其对支配胰腺的神经的作用直接或间接介导这些变化。最近有报道说,即使在没有高血糖的情况下,炎症介质也可以诱导小鼠的导管-内分泌细胞重编程,这表明炎症介质可能通过在外分泌细胞中诱导表型“转换”来抑制消化。
较早的研究表明,II-1β和TNF均可抑制兔的壁细胞的胃酸分泌。长期Il-1β暴露不仅抑制酸分泌,而且通过抑制Hedgehog信号通路促进胃萎缩。胆汁酸(BA)的合成似乎也被炎症介质所抑制。早期研究表明,BA转运体在胆管的表达降低是脓毒症相关胆汁淤积的一个因素。事实上,CYP7A1是BA合成的第一个基因,被TNF和IL-1β所超越。因此,炎性介质不仅抑制食欲,而且在各种水平上中断消化。这种对胃功能的全面抑制很可能代表了一种策略,以避免将资源投资到一个不太可能在感染期间使用的系统中。然而,这一观察也提出了两个进一步的问题。首先,如果炎症在多个水平上抑制GI功能,肠内营养支持的效果是什么?在严重的炎症反应中喂养可能是一个未被充分认识的并发症原因,通过强制参与生理过程,而这些生理过程并不打算在感染期间运作。其次,我们推测消化机械的抑制不仅仅是能量的守恒。具体而言,我们假设胃肠道的抑制是SAA的延伸,并构成免疫策略的一部分,以增强非免疫组织中的系统分解代谢。
分解代谢恢复的生存策略
炎症介质是分解代谢的有效诱导剂。事实上,细胞因子在诱导肌肉蛋白质分解、促进骨吸收和促进脂肪细胞脂解方面具有很好的作用。反过来,分解状态也驱动了最近被描述为一种“代谢紊乱”的表现,如在危重患者中总是观察到的高血糖。然而,有证据表明,分解代谢不仅仅是一种达到目的的手段(即代谢底物的释放),这本身就是一种生存策略。
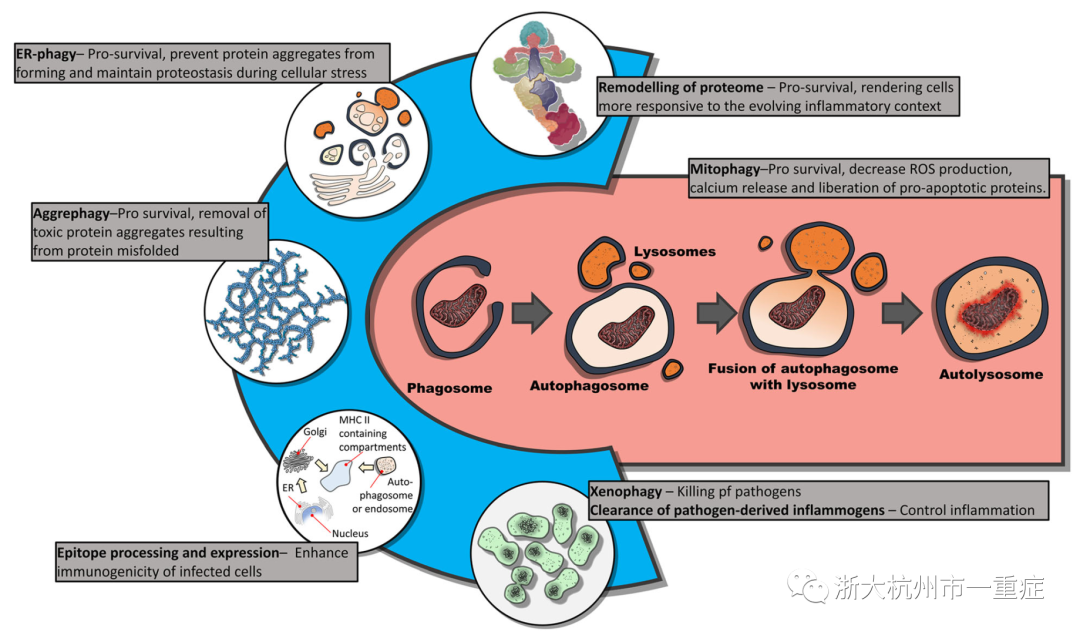
折叠错误的蛋白质代表主要的细胞危险,因为这些杂乱的蛋白质易于形成有毒的蛋白质聚集体。蛋白质可能由于变性环境或直接蛋白质破坏(例如自由基破坏)而折叠错误。有趣的是,对小鼠的研究表明,体温升高会导致热休克蛋白的表达增加:该结果表明,即使温度略微升高也可能导致蛋白质错折叠增加,从而需要增加伴侣蛋白的表达。值得注意的是,我们推测蛋白质在高热范围内的错折叠可能不会对天然状态的蛋白质提出重大挑战。换句话说,高热范围的温度不一定会引起已经正确折叠的蛋白质的变性。相反,因“折叠环境可以根据给定细胞和组织的特定需求进行微调”,新合成的蛋白质可能在发热反应期间无法达到天然构象。无论如何,内质网(ER)应激以及对ER应激的细胞反应(即未折叠的蛋白质反应)都被认为在危重病环境包括脓毒症中被激活。在这方面,分解代谢状态可以通过使细胞更有效地去除受损的蛋白质而具有保护性。尽管蛋白酶体可能降解错误折叠的蛋白质,但聚集蛋白(一种自噬的特殊形式,用于清除有毒蛋白质聚集体)将在清除泛素蛋白酶体途径过大的有毒蛋白质聚集体中起着关键作用。事实上,最近人们发现自噬在ER应激期间在维持蛋白质平衡方面起着关键作用。自噬在重塑蛋白质组方面也有很好的作用。例如,最近在癌细胞中的发现揭示了靶向降解的蛋白质池中的一种精致的选择性,这种蛋白质组的重塑可能通过减轻炎症过程来促进细胞存活。
虽然在脓毒症中公开细胞死亡实际上是罕见的,但有证据表明线粒体功能障碍增加,这表明有丝分裂可能是确保严重感染期间线粒体质量控制的关键。事实上,线粒体质量控制在正常生理条件下起着至关重要的作用。例如,甲状腺激素(T3)可引起氧化磷酸化的增加,但也可引起有丝分裂。这种看似矛盾的状态的原因是,在这种状态下,线粒体呼吸的利用率增加与线粒体清除的增加相结合,是为了改善质量控制,这是维持线粒体功能水平升高所必需的。值得注意的是,线粒体功能(例如氧化磷酸化),以及促红细胞生成素的产生,是由发热范围温度(<40°c)增强的,这表明线粒体质量控制在发热反应中也可能是至关重要的。事实上,未能去除受损的线粒体也被认为增加了促红细胞生成素的产生,这表明增强的有丝分裂可能是通过防止有缺陷的线粒体产生促红细胞生成素来保护的。总之,分解代谢机制的动员可以使线粒体质量得到更灵敏的调节,从而避免过量的促红细胞生成素产生。
我们以前已经指出,自噬可能在溶酶体酶、酰氧酰基水解酶去除炎症原(如LPS)中起关键作用。此外,自噬机制在病原体清除中也起着关键作用。事实上,自噬在病原体控制中的关键作用是显而易见的,因为病毒和细菌已经进化出许多策略来抑制和破坏自噬过程。重要的是,自噬不仅在免疫细胞中起作用,而且对非免疫细胞中的病原体感染形成关键的细胞反应。例如,IFN-γ治疗肝细胞动员了各种自噬相关蛋白,这些蛋白在LC3相关吞噬(LAP)样疟疾寄生虫的降解中起着关键作用。然而,正如所提到的,病原体也引起了破坏甚至共同选择自噬过程以维持自身生存的策略。在这方面,我们以前曾认为一种预先存在的分解状态(即上调自噬过程)可能是适应性的:由于降解过程已经在表现出分解状态的细胞中如火如荼地进行,细胞内病原体将面临一个狭窄的机会窗口来采取对策。因此,分解代谢是一种适应性策略,旨在产生一种敌对的细胞内环境,从而防止感染性物质的传播。
最后,自噬有助于MHC I和II上肽的加工和提呈。例如,自噬还可以作为不依赖蛋白酶体的替代途径,用于将病毒衍生的肽加工并加载到MHC I上。具体而言,自噬介导的加工过程可能是蛋白酶体病毒颠覆过程中的关键后备。此外,在表位产生中自噬的未开发结果是蛋白酶体和自噬可以从相似的抗原蛋白产生不同的肽。装载在MHC I上的肽的长度通常为8-12个氨基酸,MHCII在14到20之间。这意味着在MHCII上表达的蛋白质的自噬处理可能会改变潜在感染细胞的免疫原性。为了支持这种可能性,最近的研究表明,用IFN-γ治疗癌细胞改变了MHC蛋白上负载的肽的加工和长度:由于IFN-γ是自噬的有效诱导剂,自噬可能改变细胞表达的表位的免疫原性,使感染的细胞在免疫系统中更加明显。显然,有必要研究自噬产生的肽对MHC复合物的免疫意义和这些肽的潜在改变的免疫原性。
由于禁食是自噬的一种有效诱导剂,我们以前认为SAA能确保感染期间自噬活动的足够水平。在这方面,营养支持可以很好地通过提高氨基酸水平来抑制自噬,从而通过mTOR信号减弱自噬。喂养也征求生理过程,抑制分解代谢,同时促进代谢。一个经典的例子包括餐后胰岛素的释放:胰岛素是自噬的典型抑制剂,而分解性激素如胰高血糖素(通过喂养被抑制)诱导自噬。同样,我们强调营养支持的一个很少被解决的关键方面是对快速喂养周期的生理反应,特别是餐后再吸收胆汁酸的信号效应。例如,次级BAs可以通过其对G蛋白偶联的胆汁酸受体1和Farnesoid-X-受体的活性来调节免疫功能。值得注意的是,BAs对FXR的激活还可以有效抑制关键自噬基因的转录。此外,这些BA受体的激活还通过在各种免疫细胞中促进更具耐受性的表型发挥抗炎作用。
前面的讨论还强调,营养支持的其他方面,除了营养含量和抑制分解过程,可能会受到营养支持的影响。营养支持后的BA释放也可能影响免疫细胞功能,抑制自噬和血管紧张(例如增加内脏血流量)。同样,最近的专家共识指出了肠道菌群在危重病环境中的新兴作用。这就提出了一个有趣的问题:脓毒症期间的营养支持能否对宿主微生物组产生临床相关的作用?在禁食状态下,细菌种群可以被宿主分泌的o连接甘聚糖来“故意影响这个生态系统以获得更好的健康和营养”。在禁食状态下,可以通过选择更能在宿主来源的聚糖上存活的细菌种群来促进更多“驯化”的肠道菌群的存活。此外,在脓毒症期间,预后较差的患者尿液中乙醇含量较高。由于乙醇仅来自肠道菌群的发酵(患者的营养可控制24小时),因此表明微生物组可能会影响脓毒症。因此,从这些观察结果可以清楚地看出,营养支持可能会影响脓毒症期间的宿主微生物组。作为疾病行为一部分的食欲不振,加上胃系统的全面关闭,可能是一种适应性反应,旨在维持较高水平的分解代谢,尤其是自噬。值得注意的是,几种促炎细胞因子(例如TNF,II-1β,II-6,II-17和IFN-γ)已显示出调节自噬的作用。同样,与损伤相关的分子模式和由各自的TLR识别的各种与病原体相关的分子模式在激活自噬中均具有公认的作用。观察到SAA表现在炎症介质中,也诱导自噬可能没有共同证据:我们认为,先天抑制喂养是一种策略,协同收敛细胞因子诱导的分解代谢与禁食诱导的分解代谢,从而协同增强分解代谢,从而促进细胞存活和增强免疫功能(图1)。
结论
对于临床医生而言,“分解代谢”一词通常带有强烈的负面含义。但是,值得注意的是,在整个动物界中,处于非合成代谢状态的生物(例如孢子)对各种压力源表现出更大的弹性。同样,处于禁食状态的小鼠对放疗和化疗的毒性作用耐受性更高:这一观察结果构成了许多临床试验的基础。在这里,我们概述了分解代谢所引起的许多关键生理过程,并为评估脓毒症期间允许性喂养不足的有效性提供合理的理由。


相关阅读
- 09-13 第八期“浙大市一.临床大讲堂”预告
- 05-24 2021年第三届湖畔眼底病高峰论坛暨浙江省级继续医学教育项目《玻璃体视网膜疾病诊疗进展》圆满举办
- 10-29 COVID-19流行期间重症监护中的床旁肺部超声
- 10-29 肝硬化患者的自发性细菌性腹膜炎和腹膜外感染(上)
- 10-20 妊高症回顾(上)
- 10-20 妊娠期高血压疾病与心血管疾病相关发病率和死亡率的系统评价分析
- 10-07 急性心梗后超声可发现的机械性并发症
- 10-07 做了一回赵半仙--高血压心脏病
- 10-07 综合生命支持降低暴发性心肌炎死亡率的多中心研究(上)
- 10-07 经鼻雾化吸入(上)
